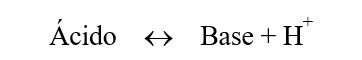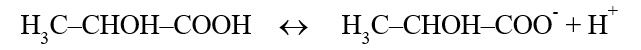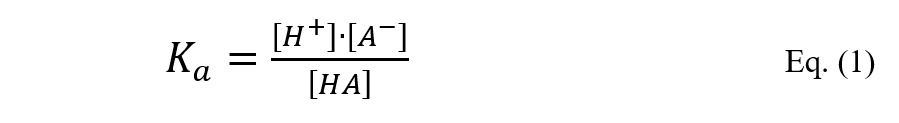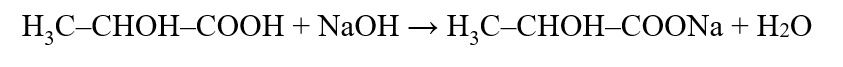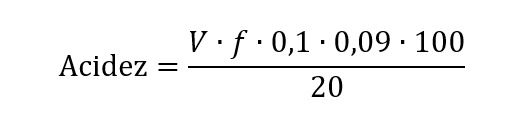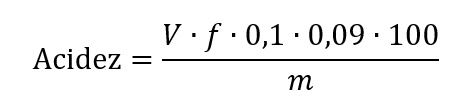A qualidade do leite é fundamental para a produção de lácteos em consonância com os seus padrões de identidade e qualidade, os quais são regulamentados por legislações específicas. Na avaliação da sua aptidão para consumo e processamento, o leite cru refrigerado, o leite pasteurizado e o leite pasteurizado tipo A devem atender às Instruções Normativas (IN) nº 76 e nº 77, ambas de 26 de novembro de 2018, do Ministério da Agricultura, Pecuária e Abastecimento – MAPA, no que tange aos seus aspectos físico-químicos, microbiológicos, composicionais e sensoriais (BRASIL, 2018a; BRASIL, 2018b).
Dentre as análises de rotina (ou testes de plataforma) realizadas pelo laboratório de físico-química do leite e derivados, a avaliação da acidez do leite via quantificação da acidez titulável e do pH é imprescindível para classificação da qualidade da matéria-prima.
A determinação da acidez do leite é amplamente utilizada tanto na inspeção industrial e sanitária do leite quanto no controle dos processos para elaboração de derivados lácteos (por exemplo, no monitoramento da fermentação durante a fabricação de leites fermentados como o iogurte). Além disso, a acidez está diretamente relacionada ao grau de aceitação dos produtos pela indústria e, principalmente, pelo consumidor.
A IN n° 77, Cap. VII (Da Recepção do Leite), Art. 31, determina que o estabelecimento deve realizar o controle da qualidade diário do leite cru recepcionado, contemplando a análise de acidez titulável (BRASIL, 2018b).
Segundo a IN n° 76, que aprova os “Regulamentos Técnicos que fixam a identidade e as características de qualidade que devem apresentar o leite cru refrigerado, o leite pasteurizado e o leite pasteurizado tipo A”, o leite íntegro deve apresentar acidez titulável entre 0,14% (m/v) e 0,18% (m/v) expressa em ácido lático (BRASIL, 2018a).
Sabendo-se da relevância do tema para a indústria de laticínios, este artigo tem o objetivo de responder às seguintes questões:
- Quais são os objetivos da análise de acidez do leite?
- Quais as diferenças entre pH e acidez titulável?
- O que é o efeito tampão no leite?
- Quais as causas de variações da acidez do leite?
- Como avaliar o caráter ácido do leite via determinação do pH e da acidez titulável?
Quais são os objetivos da análise de acidez do leite?
Como objetivos da análise de acidez do leite, podem ser citados:
- Seleção de amostras de leite para análises mais completas;
- Fornecer indicativos de fraude no leite por adição de água ou neutralizantes de acidez;
- Inspeção sanitária e verificação do estado de conservação do leite.
O leite cru de boa qualidade é levemente ácido, apresentando um pH entre 6,6 e 6,8, com média de 6,7 a 20 °C ou 6,6 a 25 °C. Este pH é conferido pelos constituintes naturalmente presentes no leite como as caseínas, fosfatos, albumina, citratos e dióxido de carbônico (CO2) dissolvido.
Entretanto, o aumento da acidez do leite pode ocorrer devido à produção de ácidos orgânicos, especialmente o ácido lático, pela ação fermentativa dos microrganismos (PEREIRA et al. 2001). Assim, a obtenção do leite em condições higiênico-sanitárias inadequadas ou o armazenamento desta matéria-prima em condições insatisfatórias favorece o crescimento microbiano que resulta no aumento da acidez, tornando-o impróprio para o consumo e processamento.
A determinação da acidez também é importante para monitorar processos de fabricação de derivados como queijos e iogurte, além de controlar a maturação do creme na fabricação de manteiga.
Quais as diferenças entre pH e acidez titulável?
Diversas reações químicas que ocorrem durante o processamento e estocagem dos alimentos são fortemente influenciadas pela variação do pH do meio (GOMES, 2003). Desta forma, a determinação do pH é fundamental para o controle de qualidade do leite, além do processamento e inspeção dos produtos lácteos.
De acordo com a definição de Bronsted-Lowry de ácidos e bases, temos:
Como exemplo, considerando o ácido lático:
Neste caso, o H3C–CHOH–COOH é o ácido (capacidade de doar prótons) e o ânion H3C–CHOH–COO- é a sua base conjugada (capacidade de receber prótons).
Ácidos e bases são classificados como fracos, médios e fortes, de acordo com o seu grau de ionização ou dissociação, respectivamente. Logo, a força de uma solução ácida (ou básica) depende da concentração de íons H+ (ou OH-) disponíveis. Esta concentração hidrogeniônica (no caso dos ácidos) depende não somente da concentração do ácido na solução, mas também da sua constante de dissociação (Ka), de acordo com a Eq. (1).
Assim, Ka representa uma relação entre a atividade dos íons e moléculas não ionizadas, que pode variar de 0 (0%) a 1 (100%).
A concentração hidrogeniônica de uma solução é normalmente expressa em termos de pH (potencial hidrogeniônico). De acordo com a definição de pH, sugerida por Sorensen em 1909, o grau de acidez ou atividade dos íons será definido com o negativo do log da atividade do íon hidrogênio, conforme a Eq. (2):
Portanto, o pH é uma medida da atividade do cátion hidrônio (H3O+) e, de acordo com a expressão de Debye-Huckel, é função da sua concentração em quantidade de matéria [H3O+], do diâmetro efetivo do íon hidratado e da força iônica (µ) do solvente (HUI, 1993).
Para soluções de baixa força iônica (µ < 0,1), a atividade do cátion H3O+ é equivalente à sua concentração, [H3O+], que normalmente é abreviada para [H+], conforme apresentado na definição de Brosted-Lowry. Logo, a Eq. (2) pode ser convertida na Eq. (3):
Além da determinação quantitativa do pH por meio de aparelho apropriado, o medidor de pH, existem diversas moléculas orgânicas, como a alizarina, que se rearranjam e mudam de cor com a alteração da concentração hidrogeniônica, sendo usadas como indicadores, ou seja, substâncias que apresentam cores bem definidas em certas regiões da escala de pH. No item 6.3 será descrito o teste do alizarol, mostrando a utilização da alizarina para investigar o pH da amostra de leite.
Já a acidez titulável é uma medida da capacidade tampão do leite para o intervalo entre o pH natural do leite (6,6 – 6,8) e o ponto de viragem da fenolftaleína, em pH 8,3. Ou seja, é dada pela quantidade de solução alcalina necessária para elevar o pH do leite desde o seu valor inicial até o pH 8,3 (PENNA et al., 2001). Os tampões são soluções que resistem a variações no pH quando são adicionadas pequenas quantidades de íons H+ ou OH-, sendo componentes fundamentais de todos os seres vivos.
O leite, logo após a ordenha, apresenta reação ácida na presença de fenolftaleína, mesmo sem a produção de ácido lático devido ao metabolismo da lactose por bactérias láticas. Esta acidez natural do leite ocorre pela presença de caseínas (2/5 da acidez), fosfatos, citratos, albumina e CO2 (2/5 da acidez), além da reação interna que ocorre durante a titulação (1/5 da acidez), conforme apresentada abaixo (PENNA et al., 2001):
A faixa normal para acidez titulável de leites provenientes de diferentes rebanhos corresponde a 0,13% (m/v) - 0,18% (m/v) expressa em ácido lático. Entretanto, praticamente não há ácido lático no leite fresco, logo, não há uma boa razão para a convenção de relatar a acidez titulável como porcentagem de ácido lático.
Devido à grande oscilação inerente, a medida da acidez titulável tem pouco valor prático, exceto para medir variações na acidez (por exemplo, durante a fermentação lática na fabricação de leites fermentados) e, mesmo para esta finalidade, sugere-se o pH como uma medida mais adequada (HUI, 1993).
O que é o efeito tampão no leite?
A capacidade tampão de uma solução (dB/dpH) é a quantidade de ácido ou base forte, em mol L-1, necessária para variar uma unidade de pH. Como o pH é uma grandeza adimensional, a unidade do índice tampão é simplesmente mol L-1.
Quando o pH é igual ao pKa, o ácido fraco está meio dissociado e a capacidade tampão é máxima. Para espécies como proteínas, que possuem numerosos grupos ácidos e básicos, o tamponamento máximo ocorre na região do pH isoelétrico (pI).
O leite apresenta considerável efeito tampão, especialmente em pH entre 5,0 e 6,0, em razão da presença de proteínas (principalmente caseínas), sais (fosfatos, citratos e lactatos) e CO2 (PEREIRA et al., 2001).
Destes, os principais componentes tampão são os sais (fosfato de cálcio solúvel, citrato e bicarbonato) e as cadeias laterais de aminoácidos ácidos e básicos nas proteínas (particularmente nas caseínas) (FOX; McSWEENEY, 1998). Por exemplo, as caseínas têm o tampão máximo próximo a pH 4,6, enquanto o fosfato tem próximo a pH 7,0 (HUI, 1993).
Com relação aos diferentes efeitos tampão no leite, destacam-se os seguintes fatores (HUI, 1993):
- A formação de fosfatos de cálcio coloidais aumenta muito a capacidade tampão dos fosfatos;
- A presença de caseínas e citrato promove a formação de fosfatos tricálcicos em níveis de pH onde os fosfatos mono e dicálcico predominariam. Isso amplia o intervalo do tampão de fosfato, movendo o ponto de saturação do fosfato de cálcio para níveis de pH mais altos;
- O ácido lático tem um pKa próximo a 4,0, de modo que os produtos lácteos fermentados têm um tampão máximo próximo ao pH 4,0;
- A formação de fosfatos de cálcio coloidais durante a concentração do leite faz com que o pH diminua. Este efeito não ocorre durante a concentração por ultrafiltração. O aquecimento também causa redução do pH devido à formação de sais de fosfato coloidais. O pH do leite diminui em cerca de 0,4 unidades no intervalo de 20 ºC a 60 °C;
- A concentração de sais do leite durante o congelamento lento faz com que o pH diminua. Entretanto, o mesmo efeito não ocorre durante o congelamento rápido.
- As propriedades ácido-base do soro de queijo são amplamente determinadas pelo pH no momento da dessoragem. Maiores quantidades de fosfatos de cálcio e maiores razões cálcio/fosfato em soros ácidos causam maior capacidade tampão e, consequentemente, uma mudança no valor máximo do tampão fosfato para um pH mais baixo.
Além destes fatores mencionados, para o soro doce (soro oriundo da coagulação enzimática do leite para fabricação de queijos) sem o fermento lácteo, a curva de titulação indica um pequeno tampão máximo devido às proteínas do soro na faixa de pH 4,0 a 5,0 (HUI, 1993).
Causas de variações da acidez do leite
A acidez do leite é influenciada por vários fatores naturais, destacando-se:
- Raça;
- Estágio de lactação;
- Alimentação do animal;
- Composição do leite;
- Mastite.
Além disso, variações da acidez do leite podem ser decorrentes de adulterações, principalmente a aguagem e a adição de neutralizantes de acidez, e também podem ser causadas pelo processamento (PENNA et al., 2001; SILVA et al., 1995).
Causas naturais de variações na acidez do leite
- Raça
Algumas raças, como vacas Jersey, podem produzir leite com acidez natural de 0,21% (m/v) a 0,23% (m/v) expressa em ácido lático, em função de sua composição mais rica em extrato seco desengordurado em comparação com vacas holandesas, por exemplo.
- Estágio de lactação
Geralmente, a acidez máxima é registrada no produto da primeira ordenha pós-parto (colostro), com valores de 0,31% (m/v) a 0,51% (m/v) expressa em ácido lático. Neste caso, o pH varia de 6,25 no 1° dia até pH 6,46 no 3° dia.
Após quatro dias, a acidez praticamente atinge o seu valor normal (em primíparas, este período pode ser mais prolongado). Já durante o decorrer da lactação os valores são relativamente constantes no mesmo animal, registrando-se pequenas variações em animais distintos.
- Alimentação
Normalmente, a alimentação do animal pouco interfere na acidez do leite. Sabe-se que produtos ácidos da forragem são eliminados pela urina, logo, há baixa possibilidade de interferência da alimentação sobre a acidez do leite.
Porém, animais em processo de acidose podem apresentar um aumento da acidez titulável do leite, principalmente em períodos do início das chuvas, quando há uma maior disponibilidade de carboidratos solúveis nas pastagens, em casos de utilização de polpa cítrica na dieta, ou ainda em situações de mudanças bruscas na alimentação do animal.
- Composição do leite
Normalmente, quanto maior a concentração de extrato seco desengordurado no leite, maior a sua acidez natural devido à presença de componentes como caseínas, albumina, fosfatos e citratos, refletindo o poder tampão no produto.
- Mastite
Infecções no úbere do animal causam alterações na composição do leite. O sangue tem um pH entre 7,3 e 7,5, aproximadamente. Consequentemente, o leite de vacas com mastite apresenta uma elevação do pH (> 7,0) e, consequentemente, menor acidez titulável.
Variações na acidez causadas por adulterações no leite
- Adição de água
A fraude com água provoca uma diluição na composição do leite, consequentemente ocasionando uma diminuição na concentração dos componentes responsáveis pela sua acidez natural, conforme já relatado neste artigo. Logo, a aguagem do leite provoca uma redução da sua acidez titulável e aumento do pH.
- Adição de neutralizantes de acidez
Adição de neutralizantes, como o hidróxido de sódio (soda cáustica), provoca diminuição na acidez do leite, podendo torná-lo alcalino.
Entretanto, para ambos os tipos de fraudes, existem análises mais específicas que devem ser realizadas a fim de se confirmar as respectivas adulterações, como a determinação do índice crioscópico (ou depressão do ponto de congelamento) para investigar a fraude com água e análises qualitativas para determinação da presença de compostos alcalinos no leite.
Variações na acidez do leite causadas pelo processamento
O processamento na indústria também influencia a acidez do leite. A concentração do leite por evaporação ocasiona aumento na acidez devido à insolubilização do fosfato de cálcio. Já o aquecimento pode reduzir a acidez, em decorrência da liberação do dióxido de carbono que estava dissolvido, como também pode promover aumento da acidez devido à insolubilização do fosfato de cálcio, degradação térmica da lactose quando este aquecimento superar 100 ºC (ocorre a formação de vários ácidos orgânicos, principalmente o ácido fórmico) e ainda, desnaturação de soroproteínas do leite que irão expor grupos de caráter ácido (SILVA et al., 1995).
Como avaliar o caráter ácido do leite via determinação do pH e da acidez titulável?
- Amostragem
Segundo PEREIRA et al (2001), para coleta da amostra de leite são recomendados agitadores com área suficiente para produzir turbulência adequada, porém sem alterar o produto, como por exemplo pelo desenvolvimento de rancidez.
Após a mistura, emprega-se um recipiente coletor com alça (Figura 1) para transferência da amostra para o frasco de acondicionamento, o qual deve ser preenchido com volume da amostra de modo a permitir a sua homogeneização antes da análise, mas prevenindo a separação de gordura durante o transporte.
Figura 1. Recipiente coletor para amostragem de leite.
Fonte: Autores.
Se houver dificuldade para obtenção de uma amostra homogênea, sugere-se a coleta de subamostras com o mínimo de 200 mL em diferentes pontos da totalidade do leite a amostrar. Em seguida, a partir da mistura das subamostras, recolhe-se uma amostra final também de 200 mL.
As amostras deverão ser acompanhadas por uma ficha assinada pelo responsável técnico, contendo as seguintes informações básicas:
- Local, data e horário de coleta;
- Código de identificação;
- Indicação de que a amostra é proveniente de subamostras, se for o caso; e
- Local de destino da amostra.
A utilização de conservantes analíticos, como por exemplo o dicromato de potássio (1 g L-1 de leite), só é permitido quando não acarretar em alterações nos resultados das análises propostas.
- Determinação do pH do leite
Fundamenta-se na medida da concentração de íons hidrogênio na amostra de leite por meio de medidor de pH (Figura 2).
Figura 2. Análise de pH do leite cru.
Fonte: Autores.
Segundo o Manual de Métodos Oficiais para Análise de Alimentos de Origem Animal, do MAPA, 2ª Edição, a técnica potenciométrica de determinação do pH do leite é descrita da seguinte forma (BRASIL, 2019):
- Calibrar o medidor de pH de acordo com as instruções do fabricante utilizando um mínimo de duas soluções padrões abrangendo a faixa de pH a ser medida;
- Efetuar a medida do pH, com correção para 20 °C;
- Reportar o resultado com uma casa decimal.
São pontos críticos desta análise: a calibração adequada do medidor de pH (as soluções padrões utilizadas devem estar dentro do prazo de validade e estocadas sob refrigeração); as temperaturas das soluções usadas para aferir o medidor de pH e da amostra devem ser iguais; e o enxágue do eletrodo deve ser feito com água purificada após cada amostra analisada e ao final do trabalho, secando-o cuidadosamente com papel absorvente. Além disso, seguir as recomendações do fabricante para conservação do eletrodo enquanto o aparelho não estiver sendo utilizado.
- Teste do alizarol do leite
Este método semiquantitativo baseia-se no mesmo fundamento do teste do álcool para estimar a estabilidade térmica do leite em presença de solução alcoólica com concentração mínima de 72 ºGL (ou 72% (v/v)) de acordo com a IN nº 76 (BRASIL, 2018a).
Porém, a presença de alizarina (indicador ácido-base) permite investigar o pH da amostra, auxiliando a diferenciação entre a acidez elevada e o desequilíbrio salino (por exemplo, no caso do leite instável não ácido – LINA).
Para realização do teste do alizarol, deve-se seguir o procedimento abaixo (COSTA JÚNIOR, 2020):
- Transferir, para um tubo de ensaio (ou placa de Petri), partes iguais (2 mL) de leite e de solução de alizarol com concentração mínima de 72 °GL;
- Misturar cuidadosamente.
Resultados do teste do alizarol no leite
- Coloração violeta: suspeita de fraude com alcalinos e/ou água;
- Coloração rósea salmão com coagulação: suspeita de desequilíbrio salino no leite (LINA);
- Coloração rósea salmão sem coagulação: leite normal;
- Coloração amarela com coagulação: leite com acidez elevada.
A Figura 3 apresenta resultados do teste de alizarol em amostras de leite cru refrigerado.
(a) Leite com acidez elevada (coloração amarela com coagulação); (b) Leite normal (coloração rósea salmão sem coagulação); e (c) Leite com suspeita de fraude com alcalinos e/ou água (coloração violeta).
Fonte: Autores.
São pontos críticos do teste do alizarol: o preparo adequado da solução de alizarol (esta deve apresentar pH igual a 7,0 ± 0,1), a medida correta dos volumes da amostra e do alizarol (partes iguais) e a adição da solução de alizarol no leite (nunca adicionar o leite na solução de alizarol).
A solução de alizarol corresponde à uma solução alcoólica de alizarina 0,8 g L-1 (PEREIRA et al., 2001). A concentração da solução alcoólica empregada como solvente deve ser proporcional ao rigor requerido no teste, devendo ter concentração mínima de 72 ºGL. Como indicadores ácido-base como a alizarina são fotossensíveis, a solução de alizarol deve ser estocada em frasco opaco.
Determinação da acidez titulável do leite
Este método aplica-se a leite cru, leite pasteurizado, leite de cabra e leite UHT. Consiste na titulação, utilizando como indicador a fenolftaleína, de uma porção da amostra por uma solução alcalina de concentração conhecida. Como convencionou-se que a acidez titulável do leite e derivados é expressa em ácido lático, a sua determinação fundamenta-se na reação química:
Onde: ácido lático reage com o hidróxido de sódio, formando lactato de sódio e água.
Para determinação da acidez titulável do leite, deve-se seguir o procedimento descrito pelo MAPA (BRASIL, 2019):
- Homogeneizar a amostra à temperatura ambiente, agitando e invertendo o recipiente ou embalagem 5 ou 6 vezes. Quando a amostra contiver grumos de creme, aquecer entre 38 °C e 40 °C em banho-maria e esfriar até temperatura ambiente agitando ocasionalmente.
- Pipetar, para um béquer de 100 mL (ou erlenmeyer de 125 mL), 20 mL da amostra. Se necessário expressar o resultado em “g de ác. lático/100 g”, registrar a massa da amostra;
- Adicionar ao béquer (ou erlenmeyer) 40 mL de água livre de gás carbônico;
- Adicionar 2 mL da solução de fenolftaleína a 1% (m/v);
- Titular com solução de hidróxido de sódio 0,1 mol L−1 até aparecimento de coloração rósea forte persistente por aproximadamente 30 segundos. Obs.: Deve-se utilizar como padrão de coloração para o ponto final da titulação uma solução de 20 mL da amostra diluída em 40 mL de água à qual se adicionou 100 µL da solução de fucsina;
- Calcular a acidez da amostra, expressa em % (m/v) de ácido lático:
Onde:
- V = volume de solução de hidróxido de sódio 0,1 mol L−1 gasto na titulação, em mL;
- f = fator de correção da solução de hidróxido de sódio 0,1 mol L−1;
- 0,09 = fator de conversão para ácido lático;
- 0,1 = concentração em quantidade de matéria, mol L-1, da solução de hidróxido de sódio;
- 20 = volume da amostra.
Se necessário expressar a acidez em “g de ác. lático/100 g”:
Onde:
- V = volume de solução de hidróxido de sódio 0,1 mol L−1 gasto na titulação, em mL;
- f = fator de correção da solução de hidróxido de sódio 0,1 mol L−1;
- 0,09 = fator de conversão para ácido lático;
- 0,1 = concentração em quantidade de matéria, mol L-1, da solução de hidróxido de sódio;
- m = massa da amostra;
Em ambos os casos, expressar o resultado obtido com duas casas decimais.
A Figura 4 mostra a análise de acidez titulável em leite fluido e a viragem do indicador de acordo com o padrão de coloração para o ponto final da titulação.
(a) Análise de acidez titulável em leite fluido; e (b) viragem do indicador de acordo com o padrão de coloração para o ponto final da titulação.
Fonte: Autores.
Para preparar a solução de fucsina P.A.: Dissolver 0,06 g de fucsina em 50 mL de álcool etílico absoluto contendo 0,5 mL de ácido acético P.A.. Completar o volume para 100 mL com álcool etílico.
São pontos críticos da análise: utilização da solução de hidróxido de sódio na concentração correta (a solução dever ser aferida de 15 em 15 dias, utilizando-se biftalato de potássio P.A. como reagente padrão primário); atenção para o ponto de viragem do indicador, que deve estar de acordo com o padrão de cor e na quantidade exata, pois para atingir o pH de viragem da fenolftaleína, deve-se combinar concentração e volume corretos deste indicador; ferver a água purificada para eliminação do CO2 antes da realização da análise e esfriar naturalmente; e leitura correta do volume gasto na titulação, além da realização da análise por laboratorista devidamente treinado.
Considerações finais
Segundo OFÍCIO-CIRCULAR Nº 56/2020/DIPOA/SDA/MAPA, de 27 de julho de 2020, cujo assunto é “Acidez em leite fluido: interpretação de resultados” (BRASIL, 2020), a IN nº 30, de 26 de junho de 2018 (BRASIL, 2018c) que estabeleceu como oficiais os métodos constantes do Manual de Métodos Oficiais para Análise de Alimentos de Origem Animal (BRASIL, 2019), alterou o método de referência de análise de acidez em leite fluido, que até então utilizava como referência o método constante na IN nº 68, de 12 de dezembro de 2006 (BRASIL, 2006), revogada pela nova norma.
Tendo em vista a constatação da diferença entre os métodos, definiu-se que os estabelecimentos sob SIF deverão adequar a metodologia de análise de acidez nos procedimentos de seleção e processamento do leite, devendo-se obrigatoriamente utilizar o método descrito no item 6.4 para determinação da acidez titulável em leite fluido (cru, pasteurizado e UHT).
Além disso, orienta-se que, em casos de resultados oficiais de acidez titulável entre 0,12% (m/v) e 0,14% (m/v) expressa em ácido lático em leite fluido, os produtos sejam autuados e retidos apenas quando existirem outras evidências de fraude além da análise de acidez.
Conclusão
A determinação da acidez do leite é imprescindível para a verificação da qualidade do leite para consumo e processamento. A IN n° 76 estabelece limites inferior e superior de acidez titulável para o leite cru refrigerado, leite pasteurizado e leite pasteurizado tipo A, mas não o faz em relação ao pH (BRASIL, 2018a).
Entretanto, os valores do pH são mais significativos que os valores da acidez titulável em relação à estabilidade do leite. E mesmo para monitorar processos fermentativos, como na fabricação de leites fermentados, recomenda-se medições de pH do produto em função do tempo ao invés da determinação da acidez titulável.
Referências
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Métodos analíticos oficiais físico-químicos para controle de leite e produtos lácteos. Instrução Normativa n. 68, de 12 de dezembro de 2006. Diário Oficial [da] República Federativa do Brasil, Seção 1, p. 8. Brasília, 14 de dezembro de 2006.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa n. 76, de 26 de novembro de 2018. Aprova os Regulamentos Técnicos que fixam a identidade e as características de qualidade que devem apresentar o leite cru refrigerado, o leite pasteurizado e o leite pasteurizado tipo A, na forma desta Instrução Normativa e do Anexo Único. Diário Oficial[da] República Federativa do Brasil, Seção 1, Brasília, 30 de novembro de 2018a.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa n. 76, de 26 de novembro de 2018. Estabelece os critérios e procedimentos para a produção, acondicionamento, conservação, transporte, seleção e recepção do leite cru em estabelecimentos registrados no serviço de inspeção oficial, na forma desta Instrução Normativa e do seu Anexo. Diário Oficial[da] República Federativa do Brasil, Seção 1, Brasília, 30 de novembro de 2018b.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa n. 30, de 26 de junho de 2018. Estabelece como oficiais os métodos constantes no Manual de Métodos Oficiais para Análise de Alimentos de Origem Animal...Diário Oficial[da] República Federativa do Brasil, Seção 1, Brasília, 13 de julho de 2018c.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Manual de Métodos Oficiais para Análise de Alimentos de Origem Animal. 2ª Edição. Brasília, 2019.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Ofício-circular Nº 56/2020/DIPOA/SDA/MAPA. Acidez em leite fluido: interpretação de resultados. Brasília, 27 de julho de 2020.
COSTA JÚNIOR, L. C. G. Métodos físico-químicos para controle de qualidade em leite e produtos lácteos (e-book - livro eletrônico). 1ª. ed. - Juiz de Fora, MG : Ed. do Autor, 2020. PDF. 681 p.
FOX, P. F.; McSWEENEY, P. L. H. Dairy chemistry and biochemistry. Department of Food Chemistry, University College. 1. ed. Blackie Academic & Professional, Cork, Irland, 1998.
GOMES, J. C. Análise de Alimentos. Universidade Federal de Viçosa. Viçosa-MG, 2003. 153 p.
HUI, Y. H. Dairy Science and Technology Handbook – Product Manufacturing. 1. ed. Vol. 1. Wiley-VCH, Inc., 1993. 427 p.
PENNA, C. F. A. M. et al. Determinação da acidez do leite. Atualização do artigo publicado no Cadernos Técnicos da EV/UFMG, nº 13, p. 63-72, 1995. Belo Horizonte-MG, 2001. 12 p.
PEREIRA, D. B. C.; SILVA, P. H. F. da.; DE OLIVEIRA, L. L.; COSTA JUNIOR, L. C. G. C. Físico-química do leite e derivados – Métodos analíticos. 2. ed. revisada e ampliada. Juiz de Fora-MG: Oficina de Impressão Gráfica e Editora Ltda., 2001. 234 p.
SILVA, P. H. F.; TORRES, K. F. Acidez, pH e efeito tampão no leite. Revista do Instituto de Laticínios Cândido Tostes. v. 50. nº 296. p. 33-41, 1995. Juiz de Fora - MG

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS