O leite é um dos principais alimentos da dieta humana. Além da função primária de nutrir e fornecer proteção imunológica para recém-nascidos, o leite e seus componentes individuais, principalmente as proteínas, são amplamente utilizados como ingredientes nos diversos segmentos da indústria de alimentos devido às suas propriedades técnico-funcionais.
O leite de vaca apresenta em média 3,23% (m/m) de proteínas, sendo 2,6% (m/m) caseínas (CN) e 0,63% (m/m) proteínas do soro. As caseínas (CN) individuais, incluindo αs1-, αs2-, β- e κ-CN, possuem conformações abertas e flexíveis e consistem em segmentos hidrofílicos e hidrofóbicos. Associam-se extensivamente e estão presentes no leite em grandes agregados, as micelas de caseína, que contêm o fosfato de cálcio coloidal (WALSTRA; WOUTERS; GEURTS, 2006; HOLT et al., 2013).
As micelas de caseína apresentam uma distribuição de tamanho entre 50 e 300 nm, com diâmetro médio de 200 nm. São formadas por um equilíbrio entre as interações hidrofóbicas e eletrostáticas, além das forças de Van der Waals.
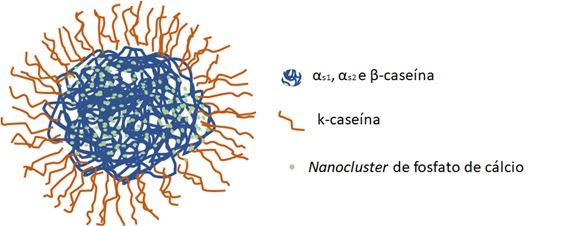
O interior das micelas é composto principalmente das caseínas αs1, αs2 e β, ligadas aos nanoclusters de fosfato de cálcio. Já a κ-CN existe principalmente na superfície da micela com a porção hidrofílica C-terminal exposta para o solvente (WALSTRA; WOUTERS; GEURTS, 2006; DALGLEISH, 2011). A Figura 1 apresenta a micela de caseína com os seus nanoclusters de fosfato de cálcio.
Figura 1. Micela de caseína.
Fonte: elaborada pelos autores.
Além de amplamente utilizadas na indústria de alimentos devido às suas propriedades técnico-funcionais e nutricionais, as proteínas do leite são biopolímeros naturais capazes de veicular moléculas bioativas e protegê-las contra a oxidação e a degradação (LIVNEY, 2009). Dentre as proteínas do leite com potencial para veicular e proteger moléculas de interesse, a β-CN tem sido estudada devido à sua capacidade de formar micelas capazes de encapsular moléculas lipofílicas em seu núcleo hidrofóbico.
Neste contexto, o artigo tem o objetivo de fazer uma breve revisão acerca desta incrível molécula, a β-CN, apresentando a sua estrutura, propriedades químicas e potencial tecnológico como molécula carreadora e protetora de compostos bioativos, assim como a sua alergenicidade intrínseca referente à variante A1 β-CN.
Estrutura da β-CN versus capacidade de veicular compostos bioativos
Nas micelas de caseína do leite de vaca, as quatro cadeias peptídicas distintas αs1-, αs2-, β- e κ-CN têm razão molar na ordem de 11:3:10:4. (WALSTRA; WOUTERS; GEURTS, 2006; HOLT, 2013). A β-CN tem sua estrutura primária constituída por 209 aminoácidos, apresentando massa molar de 24,0 kDA e pI igual a 4,8 (WALSTRA; WOUTERS; GEURTS, 2006).
Além disso, contém um elevado número de resíduos de prolina (18% da sequência de aminoácidos) e ausência de pontes dissulfeto intramoleculares, fatores que contribuem para sua conformação aberta, evitando o seu dobramento em uma estrutura globular mais organizada, apesar de possuir grandes regiões hidrofóbicas (HORNE, 2002; HOLT, 2013).
A estrutura da β-CN contém resíduos de aminoácidos responsáveis pela sua fluorescência intrínseca, dentre os quais o triptofano (Trp 143) que está localizado no domínio hidrofóbico da cadeia polipeptídica da β-CN (COGAN et al., 1976).
Composta por uma região C-terminal altamente hidrofóbica e uma região N-terminal carregada, a β-CN é uma molécula anfifílica que apresenta numerosas regiões não estruturadas na cadeia polipeptídica, o que a torna suficientemente flexível e facilmente acessível ao solvente.
Assim, em solução aquosa, a β-CN demonstra uma forte tendência à auto agregação para formar micelas. A sua concentração micelar crítica (cmc) varia entre 0,05 e 0,2% (m/v), dependendo da temperatura, pH e força iônica, sendo que as micelas de β-CN contêm 15-60 moléculas (PORTNAYA et al., 2006).
O aumento da temperatura favorece as interações hidrofóbicas e, consequentemente, influencia no número e tamanho das micelas de β-CN. Assim, a baixas temperaturas (< 10-15 °C) os monômeros de β-CN predominam. Porém, à medida que a temperatura aumenta os monômeros se associam através de ligações hidrofóbicas, formando micelas (O’CONNEL; GRINBERG; DE KRUIF, 2003). Os tamanhos das micelas também dependem do pH e da força iónica, que modificam a carga das proteínas e, portanto, as repulsões eletrostáticas.
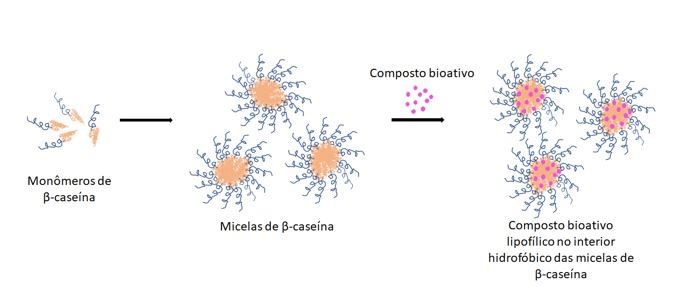
As propriedades estruturais e físico-químicas da β-CN facilitam sua aplicação na administração efetiva de diversos fármacos e compostos bioativos. A β-CN pode encapsular bioativos lipofílicos dentro do núcleo hidrofóbico das micelas formadas, aumentando a biodisponibilidade destes compostos (PERLSTEIN et al., 2014). Logo, a β-CN tem um grande potencial de aplicação, principalmente pelas indústrias de alimentos nutracêuticos e de fármacos. A Figura 2 apresenta a formação de micelas de β-CN, com o seu núcleo hidrofóbico encapsulando um composto bioativo lipofílico.
Figura 2. Formação de micelas de β-CN, com o seu núcleo hidrofóbico encapsulando um composto bioativo lipofílico.
Fonte: elaborada pelos autores.
Por exemplo, β-caroteno é um carotenoide da classe dos carotenos, utilizado como corante bioativo na indústria de alimentos. É um precursor eficaz da vitamina A, possuindo potencial ação antioxidante, protegendo o organismo humano contra carcinomas, arteriosclerose, doenças cardiovasculares, dentre outras.
Porém, sua aplicação bem sucedida em formulações de alimentos e/ou fármacos torna-se restrita devido à sua baixa solubilidade em água e baixa estabilidade química. Neste contexto, Silva et al. (2018) estudaram a interação entre β-caroteno e β-CN, avaliando inclusive a capacidade da proteína em aumentar a fotoestabilidade do composto bioativo.
Por meio da técnica de espectroscopia de fluorescência, mostrou-se que o β-caroteno forma um complexo estável com a β-CN, em pH 7,0, tanto na forma de monômero quanto de micela, aumentado a sua solubilidade. Além disso, a interação com a β-CN (monômero e micela) aumentou a estabilidade do β-caroteno à luz, sendo que as micelas de β-CN foram mais eficientes como agentes carreadores e protetores do composto bioativo.
β-CN e alergenicidade
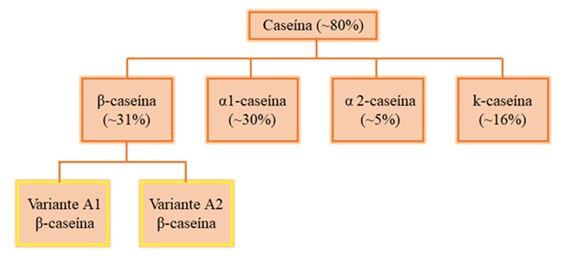
A β-CN pode existir em duas principais formas: A1 β-CN e A2 β-CN. A Figura 3 apresenta as frações de caseínas presentes no leite de vaca, incluindo as variantes A1 e A2 β-CN.
Figura 3. Frações de caseínas presentes no leite de vaca, incluindo as variantes A1 e A2 β-CN.
Fonte: elaborada pelos autores.
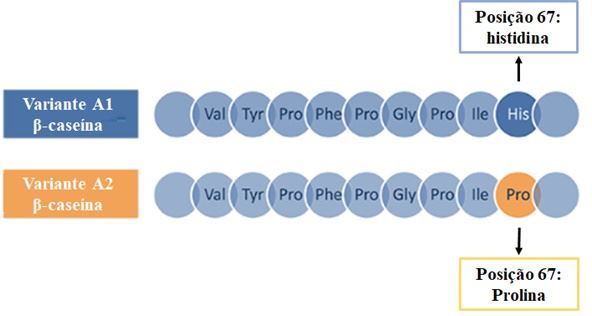
Essas duas variantes da β-CN estão presentes no leite A1 ("leite tradicional") e se diferem apenas no aminoácido presente na posição 67 da cadeia, de um total de 209 aminoácidos. Na A1 β-CN, o aminoácido encontrado na posição 67 é a histidina, enquanto que na A2 β-CN o aminoácido prolina que é encontrado nesta posição (Figura 4) (HUFNAGEL & BOGA, 2020).
Figura 4. Diferença entre as variantes A1 e A2 da β-CN.
Fonte: elaborada pelos autores.
A variante A1 β-CN tem despertado o interesse de cientistas devido a uma potencial relação com a saúde dos consumidores de leite de vaca. Durante a digestão humana, a β-casomorfina-7, conhecida também pela sigla BCM-7, é gerada a partir de proteínas do leite bovino A1, que tem se mostrado o principal fator causador de distúrbios digestivos e de saúde associados ao leite A1.
Por outro lado, nenhuma relação entre a presença de A2 β-CN e alergia à proteína do leite de vaca foi encontrada. Além disso, a estrutura da proteína A2 é mais comparável em relação ao leite materno humano, bem como aos leites de cabra, ovelha e búfalo (PARK & HAENLEIN, 2021).
Leite A2
O foco em alimentos naturais e sustentáveis é atualmente uma forte tendência no mundo, tendo efeito direto nos hábitos de compra e na alimentação dos consumidores. Ao mesmo tempo, o aspecto de saúde da nutrição está se tornando cada vez mais importante para um número crescente de consumidores.
Neste contexto, um novo tipo de leite, conhecido como leite A2, tem sido comercializado sem a presença da variante A1 β-CN e apresentando apenas a variante A2 β-CN. Assim, a gama de alimentos no mercado "com um fator de bem-estar" está em constante expansão, dentre eles o leite A2 e os seus produtos lácteos derivados.
Conclusão
Pesquisas têm apontado para o uso estratégico das proteínas do leite, como a β-CN, como nanocarreadores de compostos bioativos, aumentando a solubilidade e estabilidade destes e, consequentemente, possibilitando a sua aplicação otimizada nas indústrias de alimentos e farmacêutica. Além da capacidade carreadora dos monômeros de β-CN, estas moléculas, ao se auto agregarem, formam micelas com maior capacidade de encapsular moléculas lipofílicas em seu núcleo hidrofóbico.
Entretanto, torna-se importante a intensificação dos estudos acerca dos fatores relacionados à formação das micelas de β-CN e à sua capacidade de complexar moléculas de interesse em diferentes matrizes alimentares, tais como a presença de diferentes sais (p. ex., os sais caotrópicos e cosmotrópicos da série Hofmeister), variações de pH e de força iônica.
Referências
COGAN, U.; KOPELMAN, M.; MOKADY, S.; SHINITZKY, M. Binding affinities of retinol and related compounds to retinol binding proteins. European Journal of Biochemistry, v. 65, p. 71-78, 1976.
DALGLEISH, D. G. On the structural models of bovine casein micelles – Review and possible improvements. Soft Matter, v. 7, p. 2265–2272, 2011.
HOLT, C.; CARVER, J. A.; ECROYD, H.; THORN, D. C. Invited review: Caseins and the casein micelle: their biological functions, structures, andbehavior in foods. Journal of Dairy Science, v. 96, p. 6127-6146, out. 2013.
HORNE, D. S. Casein structure, self-assembly and gelation. Current Opinion in Colloid and Interface Science, v. 7, p. 456–461, 2002.
HUFNAGEL, A; BOGA, N. A2 milk – Milk of the future? Junho de 2020. Disponível em: https://www.eurofins.de/food-analysis/food-news/food-testing-news/a2-milk/. Acesso em: 27 de junho de 2021.
LIVNEY, Y. D. Milk proteins as vehicles for bioactives. Current Opinion in Colloid & Interface Science, v. 15, p. 73-83, 2010.
O’CONNEL, J. E.; GRINBERG, V. Y; DE KRUIF, C. G. Association behavior of β-casein. Journal of Colloid and Interface Science, v. 258, p. 33–39, 2003.
PARK, Y.W.; HAENLEIN, G.F.W. A2 Bovine Milk and Caprine Milk as a Means of Remedy for Milk Protein Allergy. Dairy, v. 2, p. 191-201, 2021.
PERLSTEIN, H.; BAVLI, Y.; TUROVSKY, T.; RUBINSTEIN, A.; DANINO, D.; STEPENSKY, D.; BARENHOLZ, Y. Beta-casein nanocarriers of celecoxib for improved oral bioavailability. European Journal of Nanomedicine, v. 6, p. 217-226, 2014.
PORTNAYA, I.; COGAN, U.; LIVNEY, Y. D.; RAMON, O.; SHIMONI, K.; ROSENBERG M.; DANINO, D. Micellization of bovine beta casein studied by isothermal titration microcalorimetry and cryogenic transmission electron microscopy. Journal of Agricultural and Food Chemistry, v. 54, p. 5555-5561, 2006.
SILVA, C. E. L.; HUDSON, E. A.; AGUDELO, A. J. P.; DA SILVA, L. H. M.; PINTO, M. S.; HESPANHOL, M. C.; BARROS, F. A. R.; PIRES, A. C. S. β-Carotene and Milk Protein Complexation: a Thermodynamic Approach and a Photo Stabilization Study. Food and Bioprocess Technology, v. 11, p. 610-620, 2018.
WALSTRA, P.; WOUTERS, J. T. M.; GEURTS, T. J. Dairy Science and Technology, 2. ed., Taylor & Francis Group, Inc. Broken Sound Parkway, New York, 763 p, 2006.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS