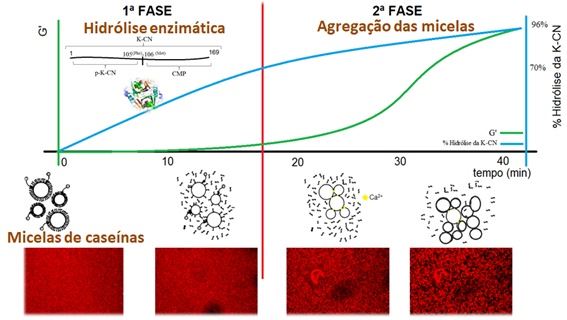
O coalho é o extrato obtido do abomaso de animais ruminantes. Este extrato é rico em proteinases ácidas que apresentam atividade coagulante sobre o leite. Já os coagulantes correspondem às demais proteases de diferentes origens, capazes de coagular o leite sob condições adequadas de temperatura e pH (Andrén, 2011). Essas enzimas apresentam papel crucial na produção de queijos, sendo fundamentais na primeira etapa da coagulação enzimática do leite (Figura 1).
As proteases encontradas no abomaso de ruminantes são a quimosina e a pepsina. A quimosina caracteriza-se por ser uma enzima de atividade altamente específica (Phe105-Met106 da κ-caseína) e com bom poder coagulante.
Por outro lado, a pepsina apresenta uma alta atividade proteolítica e baixa especificidade, podendo ocasionar a liberação de peptídeos hidrofóbicos que podem conferir sabores indesejáveis (gosto amargo em queijos frescos) (Fox et al., 2004). A concentração de quimosina e de pepsina varia em função da idade do animal, sendo encontrada na proporção 80% de quimosina e 20% de pepsina em bezerros e na proporção inversa em animais adultos.
O coalho extraído do abomaso de bezerros era considerado a melhor enzima para produção de queijos (Fox et al., 2004). A sua aplicação, entretanto, é cada vez mais restrita devido ao crescimento da produção mundial de queijos e ao decréscimo da oferta de coalho de bezerros (uma vez que há uma tendência de redução de abate precoce de novilhos em função do baixo aproveitamento em termos de produção de carnes). Assim, é crescente a busca de enzimas alternativas para substituição do coalho.
Potenciais substitutos ao coalho
Substitutos potenciais devem apresentar alta atividade de coagulação do leite (ou seja, especificidade na hidrólise da κ-caseína) e baixa atividade proteolítica em pH e temperatura de fabricação de queijos. Além disso, devem ser inativados à temperatura de pasteurização, de forma que seja possível obter um soro com boa qualidade proteica, sem restos de coagulante ativo.
Adicionalmente, devem cumprir as regras e regulamentos em vigor de cada país, restrições tecnológicas e econômicas, bem como o mercado-alvo (certificação kosher, aprovação orgânico ou vegetariano) (Rolet-Répécaud et al., 2013).
Coagulantes de origem animal
Nas últimas décadas, diversos coagulantes de origem animal, microbiana e vegetal foram considerados substitutos potenciais para o coalho (Jacob, Jaros e Rohm, 2011). Contudo, a aplicação destas enzimas na coagulação do leite poderia resultar em inconvenientes como a redução do rendimento da fabricação (decorrente da intensa atividade proteolítica destas enzimas) e o aparecimento de defeitos de aroma e sabor (especialmente o gosto amargo).
Há relatos de que as pepsinas de origem suína e avícola, esta última principalmente por questões religiosas, eram consideradas aceitáveis e aplicadas como coagulantes de origem animal para a produção de queijo (Andrén, 2011). Entretanto, essas enzimas apresentam características indesejáveis como baixa especificidade hidrolítica, com consequente defeito no sabor e na textura dos queijos (Fox et al., 2004).
Coagulantes de origem vegetal
As enzimas de origem vegetal, por sua vez, apresentam atividade proteolítica acentuada em relação ao seu poder coagulante. Com isso, provocam defeitos na massa e gosto amargo ou anormal. Desta forma, apesar de serem bastante estudadas e algumas tentativas de aplicação terem sido realizadas com ficina, bromelina, papaína, dentre outras proteases vegetais, elas não são consideradas próprias para a fabricação de queijo.
Em contrapartida, os extratos de Cynara cardunculus L. têm sido usados durante séculos na produção artesanal de queijos a partir de leite de ovelha, como o Serra da Estrela, Manchego, Torta Del Casar, La Serena ou Serpa em Portugal e Espanha, alguns deles com Denominação de Origem Controlada (Ben Amira et al., 2017).
Cynara cardunculus L. é uma variedade de cardo que cresce principalmente em áreas secas e pedregosas de Portugal e algumas outras partes da Península Ibérica. Uma característica especial destes queijos é a acentuada proteólise, resultando em um queijo cremoso e amanteigado de textura macia e sabor intenso.
No entanto, um problema para sua aplicação na fabricação de queijos em escala automática é a variabilidade de extratos não padronizados. Assim, foi realizada a fabricação de cardosina recombinante que, como a quimosina, pode ser produzida por microrganismos (Sampaio et al., 2008).
Coagulantes de origem microbiana
Diversas proteases extracelulares de origem microbiana possuem ação semelhante a quimosina e são, em parte, apropriadas para a produção de queijo (Andrén, 2011). Tais coagulantes podem ser produzidos por fermentação em produção ilimitada, além disso, como essas enzimas não são derivadas de tecidos de ruminantes são aceitas pelos lacto-vegetarianos.
Desde a década de 60 até os dias atuais mais de 100 fungos foram relatados com atividade de coagulação sobre o leite (Silva et al., 2017), o que reflete o interesse científico em coagulantes alternativos para a produção de queijo. Três espécies, Rhizomucor miehei, Rhizomucor pusillus e Cryphonectria parasitica foram estabelecidas para a produção em larga escala.
A protease aspártica produzida por R. miehei é o coagulante microbiano mais comumente utilizado para a produção de queijo e comercialmente disponível em diferentes níveis de pureza e estabilidade térmica (Jacob, Jaros e Rohm, 2011).
Na França, as preparações enzimáticas de fontes animais e fúngicas são as mais utilizadas. Na década passada, o coalho de vitelo representou 33% da demanda para a produção de queijos, quimosina recombinante apenas 14% e coagulantes microbianos 53% sendo 35% para R. miehei e 18% para C. parasitica (SPPAIL, 2015).
No entanto, ao contrário de quimosina, as proteinases destes microrganismos também clivam outras ligações da κ-caseína e possuem uma atividade proteolítica mais acentuada. Além disso, a alta estabilidade térmica foi a grande desvantagem da primeira geração de proteases fúngicas, o que significava que mesmo após a pasteurização do soro a enzima mantinha-se intacta, o que inviabilizava a aplicação deste subproduto (Jacob, Jaros e Rohm, 2011).
Apesar disso, os queijos produzidos com essas enzimas têm apresentado boa aceitabilidade (Fox et al., 2000). Contudo, mais estudos sobre a maturação de queijo com proteases fúngicas precisam ser realizados para verificar a utilidade destas enzimas.
Uso da engenharia genética para produção de coagulantes recombinantes
A baixa especificidade dos coagulantes disponíveis industrialmente e o custo do coalho alavancaram a busca de processos alternativos para obtenção de novas enzimas para aplicação no processo de coagulação do leite.
Nesta busca, a engenharia genética se tornou uma ferramenta importante, permitindo a produção de quimosina recombinante por microrganismos a partir do sequenciamento genético que leva à produção destas enzimas obtidas de vitelos e bovinos, além de animais como veados, búfalos, girafas, ovinos, caprinos, camelos e espécies de equídeos (Jacob, Jaros e Rohm, 2011).
A quimosina recombinante é idêntica, química e funcionalmente, à quimosina obtida a partir do coalho, com as mesmas condições ótimas de ação e tendo o mesmo desempenho durante a coagulação e maturação do queijo (Rampilli et al., 2005).
Estima-se que 70-80% das enzimas utilizadas na fabricação de queijos são coalhos recombinantes. Nos EUA e na Grã-Bretanha 80-90% de queijos são fabricados com quimosina recombinante (GMO Compass, 2010).
É importante ressaltar que o coalho é diferente da quimosina obtida por engenharia genética, uma vez que a primeira contém quimosina e pepsina bovina. Algumas pesquisas relataram a importância da pepsina bovina para uma melhor maturação do queijo. Como consequência disto, alguns coagulantes comerciais são formulados com quimosina produzida por microrganismos por meio de engenharia genética adicionado de pepsina bovina (Fox et al., 2000).
Além disso, o coalho animal contém uma mistura de quimosinas A, B e C na proporção aproximada de 30:55:15. Essas frações apresentam atividades e especificidades diferentes e, para o coagulante obtido por recombinação, geralmente, não ocorre a mistura de mais de um tipo de quimosina; ele é composto exclusivamente pelo tipo A ou B (Fox et al., 2000), o que pode reduzir um pouco as faixas de ação da enzima.
Novas pesquisas vêm sendo realizadas para obtenção de quimosina de outras espécies. Dentro deste contexto, trabalhos mais recentes destacam-se a utilização de quimosina obtida de camelo (Camelus dromedarius) expressa em A. niger var. awamori.
Esta enzima apresenta uma atividade específica sobre a κ-caseína de 70% superior comparada com a quimosina recombinante obtida do vitelo e uma atividade proteolítica inferior (Kappeler et al., 2006).
No entanto, mercadologicamente, os coagulantes geneticamente modificados apresentam uma restrição de uso por parte dos produtores e consumidores tradicionais, tal fato é evidente na França, país no qual apenas 14% dos queijos produzidos usam quimosina recombinante (SPPAIL, 2015).
Considerações finais
A etapa de coagulação é crítica para a produção de queijos e a busca por um coagulante substituto ao coalho de vitelo ainda persiste tanto no meio acadêmico como na indústria. O uso de engenharia genética por meio da produção de coagulantes recombinantes revolucionou o mercado, mas ainda assim, não representam uma solução final para o desafio da produção de coagulantes com custo e desempenho adequados, além de todas as certificações e questões culturais.
Gostou do conteúdo? Deixe seu like e seu comentário, isso nos ajuda a saber que conteúdos são mais interessantes para você. Quer escrever para nós? Clique aqui e veja como!
Autores
Prof. Dr. Bruno Ricardo de Castro Leite Júnior (Professor do Departamento de Tecnologia de Alimentos da UFV e coordenador do Laboratório de Inovação no Processamento de Alimentos- LIPA/DTA/UFV)
Profa. Dra. Érica Nascif Rufino Vieira, Professora do Departamento de Tecnologia de Alimentos da UFV e coordenadora do Laboratório de Inovação no Processamento de Alimentos- LIPA/DTA/UFV
Agradecimentos: Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq pelo financiamento do projeto (n° 429033/2018-4); e pela bolsa de produtividade a B.R.C. Leite Júnior (n°306514/2020-6).
Referências
Andrén, A. Cheese: Rennets and Coagulants. In J. W. Fuquay, P. F. Fox, & P. L. H. McSweeney (Eds.), Encyclopedia of Dairy Sciences, 2nd ed., (pp. 574-578). London:Elsevier Academic Press, 2011.
Ben Amira, A.; Bauwens, J.; De Pauw, E.; Besbes, S.; Attia, H.; Francis, F.; Blecker, C. Identification of proteins from wild cardoon flowers (Cynara cardunculus L.) by a proteomic approach. Journal Chemistry Biological, v. 10, p. 25–33, 2017.
Fox, P. F.; Guinee, T. P.; Cogan, T. M.; Mc Sweeney, P. L. H. Fundamentals of Cheese Science. Gaithersberg, MD, USA: Aspen Publishers, 2000.
Fox, P. F.; Mc Sweeney, P. L. H.; Cogan, T. M.; Guinee, T. P. Cheese: Chemistry, Physics and Microbiology. London: Chapman e Hall, v. 1, 617p. 2004.
GMO Compass. (2010). Chymosin. URL. https://www.gmo-compass.org/eng/database/enzymes/83.chymosin.html. Acessado em 10/07/2021.
Jacob, M.; Jaros, D.; Rohm, H. Recent advances in milk clotting enzymes. International Journal of Dairy Technology, v.64, n.1, p. 14-33, 2011
Kappeler, S. R.; van den Brink, H. J.; Rahbeck-Nielsen, H.; Farah, Z.; Puhan, Z.; Hansen, E. B.; Johansen, E. Characterization of recombinant camel chymosin reveals superior properties for the coagulation of bovine and camel milk. Biochemical and Biophysical Research Communications, v. 342, p. 647–654, 2006.
Leite Júnior, B.R.C.; Tribst, A.A.L.; Cristianini, M. The effect of high pressure processing on recombinant chymosin, bovine rennet and porcine pepsin: Influence on the proteolytic and milk-clotting activities and on milk-clotting characteristics. LWT-Food Science and Technology, v. 76, p. 351-360, 2017.
Moschopoulou, E.; Kandarakisa, I.; Anifantakis, E. Characteristics of lamb and kid artisanal liquid rennet used for traditional Feta cheese manufacture. Small Ruminant Research, v.72, p.237–241, 2007.
Rampilli, M.; Larsen, R.; Harboe, M. Natural heterogeneity of chymosin and pepsin in extracts of bovine stomachs. International Dairy Journal, v.15, p.1130–1137, 2005.
Rolet-Répécaud, O.; Berthier, F.; Beuvier, E.; Gavoye, S.; Notz, E.; Roustel, S.; Gagnaire, V.; Achilleos, C. Characterization of the non-coagulating enzyme fraction of different milk-clotting preparations. LWT - Food Science and Technology, v.50, p. 459-468, 2013.
Sampaio, P.; Fortes, A. M.; Cabral, J. M. S.; Pais, M. S.; Fonseca, L. P. Production and characterization of recombinant cyprosin B in Saccharomyces cerevisiae (W303-1A) strain. Journal of Bioscience and Bioengineering, v. 105, p. 305–312, 2008.
Silva, R. R., Oliveira, L. C. G., Juliano, M. A., Juliano, L., Oliveira, A. H. C., Rosa, J. C.; Cabral, H. Biochemical and milk-clotting properties and mapping of catalytic subsites of an extracellular aspartic peptidase from basidiomycete fungus Phanerochaete chrysosporium. Food Chemistry, v, 225, p. 45-54, 2017.
SPPAIL Syndicat Professionnel des Producteurs d’Auxiliaires Pour l’Industrie Laitière. (2015). Les enzymes coagulantes sur le marché français. URL.https://www.cniel.com/quifait/Syndicat/SPPAIL/pdf/SPPAIL_marchefrancaisenzymescoagulantes_2010.pdf.
*Fonte da foto do artigo: Freepik

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS