Introdução
A fabricação de queijo, de forma simplificada, consiste em uma transformação do leite (líquido) em uma coalhada (gel), seguida de uma concentração dos sólidos do leite. Para que isso ocorra, são necessárias várias etapas de fabricação.
Entretanto, a etapa crucial é a formação da coalhada, que pode ser obtida pelo uso do coalho ou coagulante (coagulação enzimática) ou por processo de acidificação (coagulação ácida). A seguir, será detalhada a coagulação enzimática do leite e os fatores que interferem nessa etapa.
Coagulação enzimática
A primeira e mais importante etapa na fabricação do queijo é a coagulação do leite na qual esse líquido converte-se em um gel semissólido, devido a agregação da caseína, a principal proteína do leite. A coagulação do leite pode ser realizada por meio de enzimas proteolíticas de várias origens, como as de animais (bezerro, cordeiro, cabrito, porco, galinha), de plantas (Cynara cardunculus, Ficus carica , Arctium minus e Solanum dobium ) e de fungos (Rhizomucor miehei, Rhizomucor pusillus e Cryphonectria parasita) (Rolet-Répécaud et al., 2013).
Além dessas, também se encontra no mercado os chamados coagulantes produzidos por fermentação, em que se empregam os microrganismos Kluyveromyces marxianus var. lactis, Aspergillus niger var. awamori ou Escherichia coli para produzir quimosina com a mesma sequência de aminoácidos da enzima quimosina nativa originada do estômago dos bezerros alimentados exclusivamente de leite.
Embora todas as enzimas formem a coalhada, a denominação coalho é utilizada apenas para as enzimas extraídas do abomaso do animal, enquanto as demais enzimas proteolíticas utilizadas na coagulação do leite são denominadas coagulante (COSTA et al., 2017).
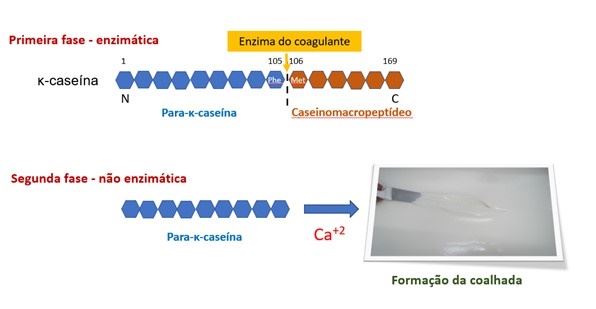
O processo de coagulação da proteína do leite ocorre em duas fases. Na primeira fase designada enzimática é fundamental a atuação do coagulante. A enzima promove uma hidrólise na ligação peptídica existente entre a posição 105 e 106, constituída pelos aminoácidos fenilananina e metionina da κ-caseína (Phe105-Met106). A região C-terminal da κ-caseína, que cobre as micelas de caseína, é tipicamente hidrofílica e no pH do leite (pH 6,7) possui carga, que possibilita a estabilidade das micelas, pela repulsão eletrostática e impedimento estérico (NICOSIA et al., 2022).
Uma vez que a κ-caseína é hidrolisada, inicia-se a primeira fase de coagulação, que divide essa proteína em dois resíduos: o resíduo caseinomacrocropeptídeo (CMP), solúvel, hidrofílico, constituído pelos aminoácidos 106-169, que fica no soro e o resíduo para-κ-caseína, insolúvel, hidrofóbico, constituído pelos aminoácidos 1-105. Esse último permanece ligado às α- e β-caseínas e, por ser altamente hidrofóbico e alcalino, conduz à desestabilização das micelas (FOX et al., 2000).
A remoção do macropeptídeo da κ-caseína reduz o potencial zeta das micelas, que estabiliza as micelas no leite (Mc SWEEENY, 2007). Inicia-se, então, a segunda fase, designada de fase secundária ou de agregação micelar, quando cerca de 80 a 90 % da κ-caseína está hidrolisada (FOX et al., 2000).
A micela de caseína é formada por submicelas de α-caseína e β-caseína que estão ligadas pelo fosfato de cálcio insolúvel e interações hidrofóbicas (NICOSIA et al., 2022). A agregação das micelas de paracaseína, após atuação da enzima, é parcialmente devida à interação de van der Waals, mas esta força em si não é suficiente. A atividade necessária de Ca+2 já aponta para isso.
Presumivelmente, o efeito dos íons Ca+2 é duplo. Primeiro, esses íons diminuem a repulsão eletrostática ao neutralizar as cargas negativas nas micelas, que reduz a estabilidade da micela. Na faixa de pH em questão, os íons Ca+2 atuam de forma mais eficaz do que os íons H+.
Em segundo lugar, os íons Ca+2 podem fazer pontes (ligações salinas) entre os locais negativos nas micelas de paracaseína (FOX, 2003). Pode-se notar ainda que a redução do pH do leite pela fermentação das bactérias láticas, leva à solubilização do fosfato de cálcio, liberado como Ca+2, o que aumenta consideravelmente a atividade do íon Ca+2 (NICOSIA et al., 2022).
Nesta fase ocorre a agregação das micelas de caseína desestabilizadas e a formação de uma rede tridimensional, denominada coágulo, coalhada ou gel, que vai aprisionando os glóbulos de gordura, a água e os materiais solúveis em água (FOX et al., 2000). Dessa forma, na fabricação do queijo ocorre um processo de desidratação no qual a gordura e a caseína do leite são concentradas de 6 a 10 vezes, dependendo da variedade (FOX, 1989). Os componentes sólidos, principalmente proteína e gordura, são concentrados na coalhada enquanto as proteínas do soro, lactose e sólidos solúveis, são removidas no soro (PAULA et al., 2009).
De forma resumida, a coagulação enzimática do leite pode ser dividida em duas fases (Figura 1): hidrólise da κ-caseína, a proteína que estabiliza a micela, seguida de agregação e geleificação das micelas modificadas pelo coalho, com a formação de um gel (Fox et al., 2017).
Figura 1. Esquema simplificado das duas etapas de coagulação enzimática do leite.
Fonte: Renata Golin Bueno Costa
Fatores que interferem na coagulação
A coagulação do leite é altamente dependente do pH, da temperatura, do teor de cálcio e de caseína, entre outros (FOX et al., 2000).
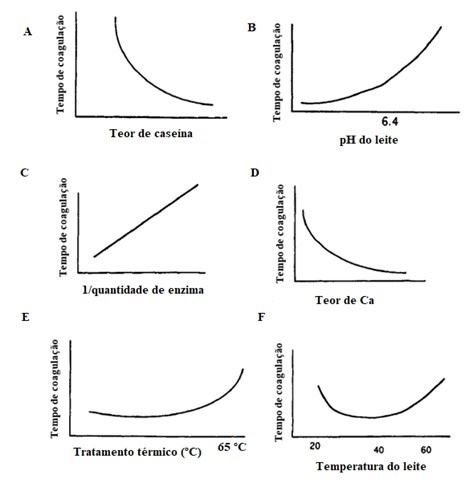
A composição do leite, principalmente a quantidade de caseína e de gordura, afetam a coagulação do leite. Como a caseína é responsável pela formação da coalhada, um maior teor de caseína reduz o tempo de coagulação do leite, conforme apresenta na Figura 2A.
Já o teor de gordura, se for aumentado sem alteração do teor de proteína aumenta o tempo de coagulação (Mc SWEENEY, 2007; TROCH et al., 2017). A contagem de células somáticas (CCS) também afeta as propriedades de coagulação do leite pela alteração da composição do leite, principalmente na diminuição do teor de caseínas (TROCH et al., 2017)
A redução do pH do leite aumenta a velocidade de coagulação (Figura 2B), que se aproxima do pH ótimo de atuação da enzima. Como o efeito do pH está relacionado com ação da enzima, sua influência é na primeira fase da coagulação (TROCH et al., 2017)
O aumento da quantidade de coalho/coagulante aumenta também a velocidade da coagulação, com impacto na primeira fase da coagulação (Figura 2C). Já o cálcio influencia principalmente na segunda fase da coagulação, cujo aumento na quantidade favorece a coagulação do leite (Figura 2D).
O tratamento térmico como a pasteurização em altas temperaturas (acima de 70ºC), dependendo do tempo de exposição, aumenta o tempo de coagulação (Figura 2E), pela desnaturação das soroproteínas sobre a caseína, dificultando a acesso da enzima à caseína (FOX et al., 2017; MCSWEENEY, 2007). Além disso, o tratamento térmico também prejudica a agregação das caseínas.
No entanto, o efeito do aquecimento na coagulação enzimática do leite pode ser revertido, se as condições de aquecimento não forem severas, por meio da redução do pH (acidificação do leite) ou adição de cálcio (FUQUAY; FOX; MC SWEENEY, 2011). Portanto, na fabricação de queijo com leite pasteurizado, a adição de cloreto de cálcio é recomendável para a formação de uma coalhada mais firme.
A coagulação é muito sensível à temperatura; não ocorrerá quando a temperatura estiver menor que 18 °C, enquanto em temperaturas mais altas, o coalho/coagulante é termicamente desnaturado (55 ºC a 60 °C, dependendo do tipo de enzima e do pH), evitando assim que ocorra a etapa da coagulação pelo coalho (Mc SWEENEY, 2007). Acima de 18 °C o tempo de coagulação diminui para um mínimo entre 40 °C - 45 °C e então aumenta novamente à medida que a enzima se torna desnaturada (Figura 2F) (FOX et al., 2017; MCSWEENEY, 2007; TROCH et al., 2017).
A redução de temperatura não só atrapalha a primeira fase da coagulação, mas também a taxa de agregação das micelas de caseína que se tornam mais lentas com a redução da temperatura de 30 ºC para 10 ºC (BANSAL; FOX; MCSWEENEY, 2008).
Figura 2. Fatores que interferem na coagulação enzimática do leite A- teor de caseína B-pH do leite C- quantidade de enzima D-teor de cálcio E- tratamento térmico (temperatura) F- temperatura do leite.
Fonte: Adaptado de FOX et al. (2000)
O sal, como NaCl, também afeta a coagulação enzimática. Adição de NaCl aumenta o tempo de coagulação e reduz a taxa inicial de agregação da caseína, provavelmente pela inibição das interações eletrostáticas no sítio ativo do complexo quimosina-caseína. Também, a adição de NaCl resulta em solubilização do fosfato de cálcio coloidal, pela substituição do cálcio pelo sódio.
A gelificação ocorre apenas se houver fosfato de cálcio coloidal suficiente presente, ou seja, é necessário que a estrutura micelar da caseína nativa esteja intacta (FUQUAY; FOX; MC SWEENEY, 2011), por conseguinte a adição de NaCl prejudica a geleificação, gerando uma coalhada mais frágil.
Além disso, a conservação do leite a frio por alguns dias antes de sua utilização para fabricação de queijo também afeta a geleificação. Isso ocorre porque, em baixas temperaturas, o fosfato de cálcio coloidal se dissolve, além da dissociação da β-caseína da micela. Esses efeitos são parcialmente reversíveis depois que o leite retorna à temperatura de coagulação (FOX et al., 2017; MCSWEENEY, 2007; TROCH et al., 2017).
Para a formação da coalhada deve-se levar em consideração todos esses fatores durante a fabricação do queijo. Uma coalhada bem formada é fundamental para a execução das demais etapas de fabricação e para garantir um bom rendimento.
Gostou do conteúdo? Deixe seu like e seu comentário, isso nos ajuda a saber que conteúdos são mais interessantes para você.
Agradecimento à FAPEMIG
Autores:
Renata Golin Bueno Costa
Crislaine da Silva Carbonaro
Marcel Gomes Paixão
Denise Sobral
Rafaela Teixeira Rodrigues do Vale
Junio César Jacinto de Paula
Referências
BANSAL, N.; FOX, P. F.; MCSWEENEY, L. H. Factors that affect the aggregation of rennet-altered casein micelles at low temperatures. International Journal of Dairy Technology, v. 61, n. 1, p. 56–61, 2008.
COSTA, R. G. B. et al. Processamento de queijos. Em: CRUZ, A. G. et al. (Eds.). Processamento de produtos lácteos. Rio de Janeiro: Elsevier, 2017. p. 11–69.
FOX, P. F. et al. Fundamentals of cheese science. Gaithersburg: Aspen, 2000.
FOX, P. F. et al. Fundamentals of Cheese Science. 2 nd. ed. Boston: Springer, 2017.
FUQUAY, J. W.; FOX, P. F.; MC SWEENEY, P. L. H. Encyclopedia of dairy sciences. 2. ed. London: Elsevier, 2011.
MCSWEENEY, P. L. H. Cheese problems solved. Boca Raton: CRC, 2007.
NICOSIA, F. D. et al. Plant Milk-Clotting Enzymes for Cheesemaking. Foods, v. 11, n. 6, 1 mar. 2022.
TROCH, T. et al. Cow milk coagulation: process description, variation factors and evaluation methodologies. A review. Base, v. 21, n. 4, p. 276–287, 2017.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS