O que é cetose bovina?
A cetose e o fígado gorduroso são transtornos metabólicos oriundos de alterações no metabolismo de lipídios e carboidratos em vacas de leite, principalmente durante o período de transição.
Invariavelmente, vacas leiteiras apresentam algum grau de balanço energético negativo (BEN) durante o período de transição em resposta a alta demanda de energia para a produção de leite e queda acentuada da ingestão de matéria seca (IMS), sendo assim incapaz de suprir essa demanda1.
Como resposta a tal necessidade, duas adaptações metabólicas ocorrem no animal. Na primeira, o metabolismo de glicose é alterado na tentativa de aumentar assim a síntese desse nutriente, e na segunda as reservas corporais de gordura são mobilizadas e convertidas em ácidos graxos não-esterificados (AGNE) para serem utilizados também como fonte de energia2.
Uma vez no fígado, os AGNE podem tomar duas vias distintas: oxidação ou esterificação. A oxidação dos AGNE pode ser completa formando CO2, ou parcial, formando os chamados corpos cetônicos, entre eles o beta-hidroxi-butirato (BHBA).
Já os AGNE esterificados são armazenados como triglicerídeos (TG) e exportados na forma de lipoproteínas de densidade muito baixa ou VLDL. Devido a alta captação de AGNE proveniente da queima acentuada de reservas corporais nesse período e baixa exportação de VLDL, natural dos ruminantes, existe armazenamento excessivo de TG no fígado, causando esteatose ou fígado gorduroso, e aumento na formação de BHBA, causando cetose3, que pode se apresentar como cetose clínica ou subclínica.
Quais os sintomas da cetose bovina?
Em bovinos, a cetose clínica é definida por elevada concentração sanguínea de corpos cetônicos (β-hidroxi-butirato ou BHBA > 27 mg/dL), associado com hipoglicemia (glicose < 45 mg/dL) e sinais clínicos da doença como: falta de apetite, anorexia, atonia ruminal, fezes secas, queda na produção de leite e sinais neurológicos como letargia, agressividade e excesso de movimentação de cabeça e língua.
Já a cetose subclínica define-se por excesso de corpos cetônicos no sangue (BHBA > 12 mg/dL), porém sem apresentação dos sinais clínicos descritos anteriormente. Por não apresentar sinais clínicos, a cetose subclínica pode trazer dificuldades para o diagnóstico, mas, é importante lembrar que a incidência da doença em rebanhos leiteiros varia entre 30 – 60%, resultando em grandes prejuízos de ordem econômica, uma vez que, vários outros transtornos e doenças do rebanho têm raiz nesse transtorno metabólico.
Prevalência e incidência da cetose em vacas
A cetose ultrapassou a acidose e a hipocalcemia como a doença metabólica mais importante nos rebanhos leiteiros dos E.U.A. desde o final da década de 9010. Cerca de metade das vacas apresentam alguma forma, de moderada a grave, de esteatose hepática imediatamente após o parto11.
Assim, não seria surpresa que a prevalência e a incidência (porcentagem de vacas desenvolvendo cetose ao longo do tempo) sejam também bastante elevadas. Tanto uma quanto a outra apresentação da doença podem variar entre rebanhos, dependendo principalmente da nutrição e do meio ambiente, mas também do método de detecção, do tempo de amostragem e dos valores de referência a serem utilizados no teste.
De maneira conservadora, considera-se a proporção entre incidência e prevalência entre 2 e 3:13. De acordo com alguns levantamentos12, estima-se que a prevalência de cetose subclínica em rebanhos leiteiros durante as duas primeiras semanas pós-parto seja de aproximadamente 25%, quando utilizado valor de referência de 1200 µmol/L.
Somando todos os custos associados com morte, descarte, serviços veterinários, medicamentos, mão de obra, retardo na concepção e produção perdida causado pela cetose, um rebanho com incidência anual da doença de 14% apresenta perdas de 250 dólares/caso ou praticamente 3500 dólares para cada 100 vacas em lactação13. Valores de BHBA alto (> 1400 µmol/L) na 1ª semana após o parto resultou em perda de 334 kg de leite para cada animal diagnosticado, considerando 305 dias de lactação14.
A maior incidência ocorre em animais de maior produção de leite, ou seja, vacas de alta produção entre a 3ª e 5ª lactação têm grandes chances de desenvolver cetose subclínica pós-parto. No Brasil existe um agravante que é a alta temperatura e umidade ao longo ano, principalmente no verão nos estados de maior produção leiteira, entre eles MG, RS, PR, GO, SP e SC.
Animais com estresse térmico e falta de conforto têm mais chances de apresentarem cetose e qualquer outro tipo de doença infeciosa e metabólica durante o periparto. Isso, quando comparados aos rebanhos encontrados em ambiente com temperatura, umidade e conforto adequados.
Em estudo realizado em MG e PR em mais de 1.500 animais, a prevalência de cetose subclínica durante a 2ª semana pós-parto em vacas leiteiras, sob diversos tipos de manejo, entre os meses de abril e julho, gira em torno de 26%, considerando primíparas e multíparas. Assim, espera-se que no Brasil, em média, 60% de um rebanho sofra com a cetose subclínica e seus prejuízos ao longo da lactação.
Outro dado relevante é que em rebanhos de gado cruzado, principalmente Girolando, em sistema de pastejo com suplementação de concentrado diário, a cetose subclínica causa prejuízos, inclusive naqueles com média de produção diária de 12-15 kg de leite.
E, muitas vezes, devido à menor velocidade desses animais em produzir leite, comparado com outras raças de grande mérito leiteiro, a doença pode aparecer não só durante os primeiros 10 dias pós-parto, mas adiante até a 3ª e 4ª semana de lactação, já que o balanço energético negativo pode acabar acontecendo, mais pronunciadamente próximo ao suposto pico de lactação.
Como prevenir a cetose em bovinos?
Estratégias de manejo e alimentação adequados são fundamentais para a prevenção da cetose subclínica em rebanhos leiteiros. Entre elas:
Manejo da condição corporal durante o final da gestação
Animais obesos, ou seja, com escore de condição corporal maiores de 3,5 (escala de 1 – 5) são mais propensos a desenvolver fígado gorduroso e cetose. Geralmente a ocorrência de vacas obesas em rebanhos leiteiros é consequência de lactação prolongada, e lactação prolongada é resultado de baixa eficiência reprodutiva. Vacas com períodos extensos de lactação tendem a ganhar mais peso e chegar ao período seco com excesso de reserva corpórea. Dessa forma é relativamente normal encontrar em rebanhos de baixa eficiência reprodutiva maior ocorrência de cetose clínica e subclínica.
Balanço adequado de nutrientes
Tanto dietas com alta e com baixa densidade energética no final da gestação podem comprometer a saúde do animal, por acentuar o balanço negativo nessa fase e levar ao desenvolvimento de cetose. Por isso, mais importante que a densidade energética do alimento são as mudanças no consumo durante esse período. Dietas que permitem menores mudanças abruptas na ingestão são mais favoráveis. É recomendável oferecer dietas com nível mediano de FDN (35 – 40%) para assegurar uma densidade energética adequada, e que a fonte dessa FDN seja, principalmente, de forragens com tamanho longo de partículas (5 – 8 cm de comprimento) para estimular o enchimento e as contrações ruminais – evitando alterações abruptas no consumo.
Uso de aditivos na dieta
Existem inúmeros aditivos disponíveis no mercado com a finalidade de reduzir a ocorrência da cetose subclínica. Deve-se priorizar o uso de aditivos que aumentem o aporte energético ou que melhorem o metabolismo de lipídeos no fígado desses animais.
a) Aditivos melhoradores de desempenho ionóforos e não-ionóforos: Estes aditivos produzidos pelas mais variadas espécies de bactérias do gênero Streptomyces sp. são capazes de selecionar inúmeras bactérias específicas no rúmen e favorecer a produção de ácidos graxos importantes, aumentando o aporte de energia ao animal. As moléculas dessa categoria mais conhecidas são a monensina sódica e virginiamicina. Vários estudos demonstram a eficiência da monensina sódica em reduzir a produção de AGNE e BHBA em resposta ao maior aporte energético devido à maior produção de ácido propiônico no rúmen. A virginiamicina tem se mostrado muito eficaz no controle da produção de lactato no rúmen, reduzindo a acidose lática e prevalecendo o consumo de alimentos de forma mais segura e regular. A associação das duas moléculas tem se mostrado promissora para o ótimo desempenho do rebanho. Recomenda-se 300-340 mg de virginiamicina/animal/dia e 200-300 mg de monensina/animal/dia.
b) Precursores glicogênicos: Entre eles propionato de cálcio, propileno glicol e glicerol. Todos esses produtos oferecem precursores para a síntese de glicose no fígado. O interessante da molécula de propionato de cálcio, é que além fornecer o propionato, ela ainda fornece cálcio, mineral de extrema importância nesse período. Infelizmente esses ingredientes – quando incorporados – à dieta inibem o consumo de matéria seca, e acabam tendo consumo esporádico pelo animal. Para que o uso seja efetivo, deve-se fornecer via oral, por exemplo, através do uso de sonda esofagiana, também conhecida no campo como “Drench”. A quantidade sugerida varia entre 400-500 gramas em uma única dosagem - restrita às últimas duas semanas de gestação e aos primeiros 10-15 dias pós-parto.
c) Amino ácidos e vitaminas do complexo B: São elementos fundamentais em muitos processos metabólicos que afetam o metabolismo de carboidratos e lipídeos. Nessa categoria os mais expressivos em respostas à prevenção de cetose e fígado gorduroso são: Colina, Niacina e Metionina. Além de reduzir as concentrações de AGNE no sangue a aumentar a exportação de VLDL hepática, a suplementação correta deles durante o período de transição pode aumentar a produção e teor de gordura no leite, além de reduzir inúmeras outras doenças de fundo energético. Para uso em ruminantes, é importante que essas moléculas sejam oferecidas com algum revestimento e proteção à ação ruminal. Dessa forma preserva-se a substância para que seja absorvida diretamente no intestino e não seja perdida pelos micro-organismos do rúmen do animal. Dosagens:
- Colina: De 10-15 gramas/animal/dia durante pré-parto, e de 15-20 gramas/animal/dia durante o pós-parto;
- Niacina: De 12-15 gramas/animal/dia durante peri-parto;
- Metionina: De 5-10 gramas/animal/dia na finalidade de atingir níveis adequados ao balanço Lisina e Metionina metabolizável numa relação de 3,1:1 ou seja; 7,2% e 2,6% respectivamente.
d) Propionato de cromo: Entre todas as moléculas de cromo, o proprionato de cromo é o único aprovado pelo FDA (Food and Drug Administration), órgão nos EUA similar à ANVISA no Brasil para o uso em bovinos e seres humanos. Inúmeros estudos já foram realizados com cromo dentro e fora do Brasil, mas só recentemente pesquisadores da UNESP de Botucatu demostraram a magnitude da resistência insulínica em vacas de leite e como o propionato de cromo pode atenuar esses efeitos. Uma vez que a resistência insulínica diminui a entrada de glicose das células do organismo por deixá-las menos sensíveis à insulina, a suplementação de propionato de cromo favorece essa captação de glicose nos tecidos, dessa forma menos reservas são mobilizadas e menores são as chances do animal desenvolver cetose subclínica. Recomenda-se entre 10-12 mg de propionato de cromo por animal/dia durante o ano todo - inclusive no período seco.
Impacto e prejuízo da cetose no rebanho
Vários estudos epidemiológicos somando mais de 450.000 animais demostraram que em média a cetose subclínica está associada com redução de 5% na produção de leite em toda a lactação. O impacto econômico direto de uma fazenda de 3.000 litros de leite/dia é de menos 150 litros de leite, ou seja, esse produtor deixa de produzir, praticamente, 55.000 litros de leite ao longo do ano.
Porém os grandes prejuízos estão relacionados ao aparecimento de outras doenças de raiz energética. A prevalência da cetose subclínica está associada ao aumento de cetose clínica, deslocamento de abomaso, retenção de placenta, metrite/endometrite, mastite e hipocalcemia em propriedades leiteiras. Dessa forma, os prejuízos causados por tratamentos, descarte dos animais, descarte de leite, mão de obra, além de baixa produção e eficiência reprodutiva são, muitas vezes, irreversíveis durante a lactação.
A melhor maneira de reduzir as doenças descritas acima é melhorando o status energético do rebanho - reduzindo a cetose subclínica por meio de um ótimo monitoramento diário e pensando em estratégias de alimentação e manejo aplicáveis à propriedade.
Atualmente, sem sombra de dúvidas, a cetose subclínica acomete entre 50-60% dos animais de todos os rebanhos de média/grande produção do nosso país - de Norte a Sul.
Programas de monitoramento
Atualmente, estima-se que de 30 a 50% das vacas de leite são afetadas por alguma forma de doença metabólica ou infecciosa durante o periparto. A alta concentração sérica de AGNE (> 0,4 mmol/L) entre 7 e 10 dias antes do parto estão associados ao aumento do risco de deslocamento de abomaso, retenção de placenta, descarte antes dos 60 dias em lactação e queda na produção de leite nos 4 primeiros meses de lactação.
A cetose subclínica, aferida por valores séricos de BHBA maiores que 1200 µmol/L entre a 1ª e 2ª semana após o parto, também está associada ao aumento dos casos de cetose clínica, torção de abomaso, retenção de placenta, metrite e endometrite, prolongamento do anestro pós-parto, aumento da gravidade da mastite e queda na produção de leite4.
O principal objetivo dos programas de monitoramento de saúde de rebanhos leiteiros é detectar problemas precocemente a fim de permitir intervenção, limitando assim as consequências geradas diretamente pelos custos do tratamento, e por consequência, os prejuízos relacionados a queda no desempenho produtivo e reprodutivo dos grupos de animais avaliados.
Práticas rotineiras simples como o registro de doenças clínicas, mensuração do consumo de ração, produção de leite e escore de condição corporal são fundamentais para o sucesso da prevenção de distúrbios metabólicos durante a transição.
Nos dias de hoje, existem técnicas de monitoramento que através da mensuração de alguns metabólitos específicos, como BHBA, permite que o técnico avalie o “status” energético dos animais, possibilitando mudanças que possam ser feitas cujo objetivo é minimizar a incidência e prevalência de cetose subclínica do rebanho.
Monitorando a ocorrência de cetose subclínica
Em termos de cetose clínica, a avaliação pode ser muito subjetiva, dependendo diretamente da habilidade do técnico ou funcionário em detectar a doença. Uma vez que os custos relacionados a cetose subclínica são maiores do que os da cetose clínica5, torna-se indispensável o monitoramento preciso e precoce da cetose subclínica.
A mensuração de BHBA sempre foi considerada difícil, demorada e onerosa porque depende de coleta de amostras de sangue para serem enviadas aos laboratórios, ou depende da coleta de leite e urina que são muitas vezes inviáveis, principalmente em rebanhos menores.
Assim, até recentemente, não havia disponível no mercado testes que permitissem o técnico mensurar a cetose subclínica no campo. Atualmente, disponibilizou-se um exame de sangue para ser realizado ao lado do animal, que é fácil de usar, altamente sensível e específico, e razoavelmente econômico.
O medidor digital é comercializado pela empresa canadense Abbott Laboratories, com nome de Precision Xtra® nos E.U.A., e Optium Xceed® no Brasil. Esse aparelho foi elaborado para uso humano, mas de acordo com várias estudos5,6,7, é também indicado para bovinos leiteiros.
Para que o teste seja realizado de forma adequada é necessário que uma gota de sangue do animal seja colocada em uma tira reagente já inserida no medidor que vai determinar a concentração sanguínea de BHBA em poucos segundos.
Interpretação do teste
De maneira geral, a cetose é detectada nas primeiras duas semanas após o parto. Na prática deve-se controlar a entrada de vacas no período seco com condição corporal alta, priorizando escores que devem variar entre 3 e 3,54. Ainda, deve-se evitar o fornecimento excessivo de energia entre a secagem e o parto8, focando especialmente em medidas que maximizem o consumo de alimento nas últimas semanas pré-parto9.
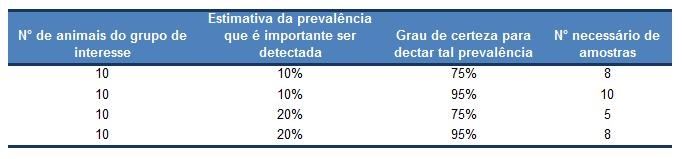
O número de amostras necessárias para interpretação do teste depende da prevalência dos animais acometidos pela doença, do grau de certeza desejado e do tamanho do grupo de interesse. Em termos práticos, com o mínimo de 5 amostras já é possível realizar o teste, e usando de 10 a 12 amostras, o técnico está apto a interpretar a maioria dos casos10 (ver Tabela 1).Com o monitor utilizado ao pé da vaca, o valor de referência (“cut-off values”) para cetose subclínica é de 1200 µmol/L, e uma prevalência (porcentagem de animais diagnosticado com a doença num determinado momento) acima de 10% é considerada alarmante. Como citado acima, as amostras devem ser coletadas durante os primeiros 15 dias após o parto, sempre no mesmo horário, de preferência entre 4 a 5 horas após o arraçoamento3.
Referências
1) J.K. Drackley, 1999. Biology of dairy cows during the transition period: The final frontier? J. Dairy Sci. 82:2259-2273.
2) A.A. Adewuyi et al., 2005. Non-esterified fatty acids (NEFA) in dairy cattle: A review. Vet Q. 27:117-126.
3) R.R. Grummer, 2011. Estratégias para previnir fígado gorduroso e cetose subclínica. Anais do XV curso “Novos Enfoques na Produção e Reprodução de Bovinos”. Uberlândia.
4) S. LeBlanc, 2012. Monitoramento da saúde metabólica de gado de leite durante o período de transição. Anais do XVI curso “Novos Enfoques na Produção e Reprodução de Bovinos”. Uberlândia.
5) G.R. Oetzel, 2010. Evaluation of hand-held Precision Xtra system for diagnosing ketosis in early lactation dairy cows. In: 2010 Joint Annual ASAS/ADSA Meeting. Denver.
6) M. Iwersen et al., 2009. Evaluation of an electronic cow-side test to detect subclinical ketosis in dairy cows. J. Dairy Sci. 92:2618-2624.
7) J. Hubbard et al., 2010. The effect of storage temperature on the accuracy of a cow-side test for ketosis. Can. Vet. J. 51:525-526.
8) H. M. Dann et al, 2006. Diets during far-off and close-up dry periods affect periparturient metabolism and lactation in multiparous cows. J. Dairy Sci. 89:3563-3577.
9) J.K. Drackley. 2007. New approaches to feeding dry cows. In: Tri-State Dairy Nutrition Conference. Fort Wayne.
10) G.R. Oetzel. 2004. Monitoring and testing dairy herds for metabolic diseases. Vet. Clin. N. Amer. Food. Anim. 20:651-674.
11) J.A.A. Pires & R.R. Grummer, 2009. Should protected choline or niacin be fed to periparturient cows? Anais do XIII curso “Novos Enfoques na Produção e Reprodução de Bovinos”. Uberlândia.
12) T.F. Duffield et al., 2009. Impact of hyperketonemia in early lactation dairy cows on health and production. J. Dairy Sci. 92:571-580.
13) C. Guard, 2008. The cost of common diseases of dairy cattle. In: 2008 CVC Meeting. San Diego.
14) C.J. McLaren et al., 2006. The relationship between herd level disease incidence and a return over feed index in Ontario dairy herds. Can. Vet. J. 47:767-773.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
















