A tecnologia de alta pressão é utilizada nas indústrias de laticínios, podendo ser aplicada para o melhorar a performance da coagulação do leite para a produção de queijos.
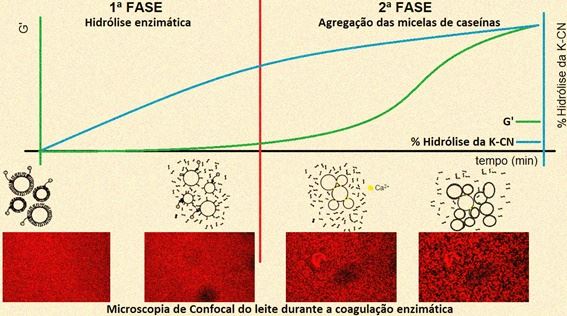
As enzimas possuem grande importância para a produção de alimentos. Na área de leite e derivados, uma das principais aplicações é na fabricação de queijos, cuja etapa inicial de produção envolve a coagulação enzimática do leite (Figura 1).
Figura 1. Ilustração do processo de coagulação enzimática do leite na fabricação de queijos. G’: Parâmetro reológico que determina a consistência do gel.
*Para maiores detalhes consultar Leite Júnior et al. (2017a).
A coagulação do leite é uma etapa crítica do processo de fabricação de queijos em virtude do tempo de duração e dos efeitos dessas enzimas sobre as características sensoriais e o rendimento do produto final.
Desta forma, ao longo das últimas décadas vários avanços em pesquisas foram realizados na busca da melhoria e do desenvolvimento de novos coagulantes, considerando:
- Custo;
- Atividade/especificidade;
- Características do produto final obtido.
Neste contexto, o processamento por alta pressão (AP) pode ser uma tecnologia interessante no processo de modificação de enzimas visando a melhoria da sua performance. Nos trabalhos realizados por Leite Júnior et al. (2015, 2016, 2017ab, 2018, 2019) a tecnologia de AP foi utilizada para maximizar a atividade de coagulação do leite (ACL) de cinco coagulantes:
- Protease obtida do Rhizomucor miehei;
- Coalho de vitelo;
- Quimosina recombinante;
- Coalho de bovino;
- Pepsina suína.
Com base nos resultados, os autores verificaram que o processo foi capaz de promover ativação, inativação ou não alterar a atividade dos coagulantes em função das condições de processo. De forma geral, pressões até 300 MPa por tempos ≤ 10 min e temperaturas ≤ 25 °C, promoveram ativação (aumento de 14% para pepsina suína até 23% para quimosina recombinante).
Por outro lado, em condições mais drásticas observou-se redução da atividade enzimática, com completa inativação em processos realizados acima de 550 MPa com tempos >10 min e temperaturas >45 °C.
Possivelmente, esses resultados se devem aos diferentes efeitos promovidos pelo processo sobre a estrutura da enzima. Dentre esses efeitos, acredita-se que a ativação esteja correlacionada com a modificação conformacional da molécula. Essa modificação pode induzir um aumento na exposição de sítios ativos, explicando o fenômeno observado.
No entanto, para cada enzima há um limite de pressão a ser aplicado, a partir do qual se observa uma desnaturação com perda de funcionalidade. O estudo realizado por Leite Júnior et al. (2017b) mostrou que, em relação à estrutura terciária, o processo aumentou a fluorescência intrínseca em condições de ativação e promoveu uma drástica redução desta fluorescência em condições de inativação, indicando que em condições de ativação ocorreu um desdobramento proteico, o qual foi intensificado nas condições de inativação.
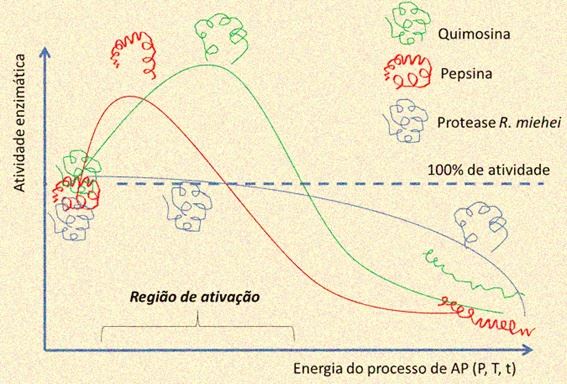
A análise de espectroscopia de ATR-FTIR mostrou que o processo de AP resultou em alterações nas estruturas secundárias com maiores alterações observadas em maiores pressões. Desta forma é possível concluir, que pequenas alterações estruturais levaram ao aumento de atividade —possivelmente por maior exposição de sítios ativos — e estabilidade dos coagulantes, enquanto que alterações mais severas levaram à sua completa inativação. A Figura 2 ilustra o efeito do processo de AP sobre a atividade dos coagulantes.
Figura 2. Ilustração do efeito do processo de AP na atividade dos coagulantes.
Em condições otimizadas, os coagulantes processados por AP — principalmente aqueles com alta concentração de quimosina — apresentaram maior grau de hidrólise sobre a κ-CN em comparação às enzimas não processadas (Leite Júnior et al., 2019). Além disso, a pressurização melhorou a estabilidade das enzimas em diferentes valores de pH após o processamento e em pH ótimo de atividade ao longo da estocagem (Leite Júnior et al., 2017a).
A pepsina suína foi o coagulante mais sensível ao processo de API (Leite Júnior et al., 2017a) e a protease obtida do R. miehei apresentou maior resistência ao processo e a única sem ativação (Leite Júnior et al., 2016).
Para esta enzima, o processo apresentou resultados satisfatórios apenas para inativação, com maior taxa de inativação (menor valor de D) durante o processo a 600 MPa / 25 °C em comparação com os processos térmicos de pasteurização comumente realizados em condições industriais, sendo uma alternativa interessante para obtenção de soro de leite sem residual de atividade.
Essas diferenças podem ser explicadas pela composição e conformação molecular de cada enzima. A maior resistência da protease produzida pelo R. miehei ao processo de AP em relação às outra se deve à presença de oligossacarídeos que ajudam a estabilizar a estrutura terciária desta protease (Yang et al., 1997).
No estudo de Leite Júnior et al. (2018) verificou-se que as enzimas processadas por API em condições de ativação apresentaram maior atividade de coagulação do leite (ACL) em diferentes condições de pH e temperatura.
Destaca-se os resultados obtidos para a quimosina recombinante, na qual a pressurização aumentou a ACL em pH natural do leite (pH 6,6), resultando em uma atividade semelhante à observada para a enzima nativa em pH mais baixo e temperatura mais elevada.
Tal observação permite que o processo de coagulação ocorra em temperaturas mais baixas ou em valores de pH mais elevados, promovendo reduções de custos como:
- Economia de energia para aquecer o leite;
- Ganho de tempo no processo de aquecimento e pela não necessidade de pré-acidificação;
- Uso de menor quantidade de enzima e/ou acidificante.
Para avaliação dos efeitos em termos práticos, a coagulação do leite pelas enzimas ativadas por AP foi acompanhada pelos métodos de: espectroscopia no infravermelho próximo (avalia a determinação do grau de agregação proteica), ensaio reológico (determina a força do gel) emicroscopia confocal (pode ilustrar a porosidade do gel) (Leite Júnior et al., 2017a).
Esses resultados demonstraram que as enzimas processadas por AP em condições otimizadas promoveram uma coagulação mais rápida e que os géis produzidos foram mais consistentes e com maior grau de agregação da rede proteica em comparação com aqueles produzidos utilizando as enzimas não processadas. Estes efeitos são atribuídos ao maior grau de hidrólise da fração k-CN durante a primeira fase de coagulação (Leite Júnior et al., 2019).
Em termos de rendimento, verificou-se que os géis obtidos com as enzimas processadas por AP apresentaram um maior rendimento em comparação com aqueles obtidos a partir das respectivas enzimas não processadas com um aumento de até 4,3% (Leite Júnior et al., 2017a).
Desta forma, certifica-se que tais modificações em níveis de atividade de coagulação do leite resultaram em efeitos benéficos durante a etapa de coagulação e nos géis obtidos. Com base nesses resultados é possível afirmar que o processo de AP é uma alternativa para melhorar o desempenho dos coagulantes do leite — especialmente daqueles que contêm fração de quimosina.
Ele permite a redução da quantidade de enzima utilizada no processo de fabricação de queijos, com consequente redução de custos. Entretanto, uma avaliação da viabilidade econômica do processo deve ser realizada para verificar os custos envolvidos na modificação das enzimas utilizando o processamento por alta pressão.
Agradecimentos: a Fundação de Amparo à Pesquisa do Estado de São Paulo - FAPESP
Gostou do conteúdo? Deixe seu like e seu comentário, isso nos ajuda a saber que conteúdos são mais interessantes para você. Quer escrever para nós? Clique aqui e veja como!
Autores
Prof. Dr. Bruno Ricardo de Castro Leite Júnior, Professor Departamento de Tecnologia de Alimentos da UFV e coordenador do Laboratório de Inovação no Processamento de Alimentos- LIPA/DTA/UFV;
Dra. Alline Artigiani Lima Tribst , Pesquisadora do Núcleo de Estudos e Pesquisas em Alimentação - NEPA/ UNICAMP;
Prof. Dr. Marcelo Cristianini, Professor do Departamento de Tecnologia de Alimentos da FEA-UNICAMP e coordenador do Laboratório de Tecnologias Emergentes no Processamento de Alimentos.
Referências
LEITE JÚNIOR, B.R.C.; TRIBST, A.A.L.; BONAFE, C.F.S.; CRISTIANINI, M. Determination of the influence of high pressure processing on calf rennet using response surface methodology: effects on milk coagulation. LWT-Food Science and Technology, v. 65, p. 10-17, 2015.
LEITE JÚNIOR, B.R.C.; TRIBST, A.A.L.; CRISTIANINI, M. Comparative effects of high isostatic pressure and thermal processing on the inactivation of Rhizomucor miehei protease. LWT-Food Science and Technology, v. 65, p. 1050-1053, 2016.
LEITE JÚNIOR, B.R.C.; TRIBST, A.A.L.; CRISTIANINI, M. The effect of high pressure processing on recombinant chymosin, bovine rennet and porcine pepsin: Influence on the proteolytic and milk-clotting activities and on milk-clotting characteristics. LWT-Food Science and Technology, v. 76, p. 351-360, 2017a.
LEITE JÚNIOR, B.R.C.; TRIBST, A.A.L.; GRANT, N.J.; YADA, R.Y.; CRISTIANINI, M. Biophysical evaluation of milk-clotting enzymes processed by high pressure. Food Research International, v. 97, p. 116-122, 2017b.
LEITE JÚNIOR, B.R.C.; TRIBST, A.A.L.; YADA, R.Y.; CRISTIANINI, M. Milk-clotting activity of high pressure processed coagulants: Evaluation at different pH and temperatures and pH influence on the stability. Innovative Food Science & Emerging Technologies, v. 47, p. 384-389, 2018.
LEITE JÚNIOR, B.R.C.; TRIBST, A.A.L.; RIBEIRO, L.R.; CRISTIANINI, M. High pressure processing impacts on the hydrolytic profile of milk coagulants. Food Bioscience, v. 31, p. 100449, 2019.
YANG, J.; TEPLYAKOV, A.; QUAIL, J. W. Crystal structure of the aspartic proteinase from Rhizomucor miehei at 2.15 Å resolution. Journal of Molecular Biology. v. 268, p.449-459, 1997.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS