Este texto é parte da palestra apresentada por Daniel L. Grooms, no XIV Curso Novos Enfoques na Produção e Reprodução de Bovinos, realizado em Uberlândia em março de 2010.
Introdução
A eficiência reprodutiva é um dos principais fatores envolvidos na viabilidade econômica do setor de criação de bovinos (Feuz e Umberger, 2003; Wolf, 2003). Fatores que afetam a reprodução têm impacto econômico significativo sobre produtores cujas operações dependem da produção de crias saudáveis e viáveis. As causas da ineficiência reprodutiva são diversas e numerosas, indo desde erros simples de manejo, até conjuntos complexos de enfermidades multifatoriais. As enfermidades infecciosas podem constituir uma causa importante de ineficiência reprodutiva. Muitas bactérias, vírus, protozoários, fungos e parasitas foram associados às perdas reprodutivas em bovinos. Este artigo é uma breve revisão das causas infecciosas mais comuns de perdas reprodutivas em bovinos.
Incidência
As doenças infecciosas têm relação com infertilidade, mortes embrionárias precoces, abortos e defeitos congênitos, e são frequentemente referidas como causas de tais perdas por laboratórios de diagnóstico (Tabela 1). A ocorrência de doenças infecciosas foi documentada em aproximadamente 40-50% dos casos de abortos em bovinos (Jerrett et al., 1984; Anderson et al., 1991; Yamini et al., 1990; Kirkbride, 1992a; Kirkbride 1992b; Khodakaram-Tafti e Ikede, 2005; McEwan e Carman, 2005). A incidência de causas infecciosas específicas de perdas reprodutivas pode variar de acordo com vários fatores, da região do país à época do ano. O conhecimento da maneira como tais fatores podem influenciar a incidência de patógenos específicos é importante na elucidação da causa das perdas reprodutivas. Abortos causados por sorovares de Leptospirose que não o hardjo, por exemplo, podem ocorrer nas épocas do ano em que os animais têm mais acesso a ambientes frequentados por animais selvagens, que podem ser hospedeiros de manutenção. Por outro lado, uma vez que os bovinos são os hospedeiros definitivos da L. hardjo, os abortos podem ocorrer sempre que bovinos não infectados entram em contato com bovinos que estão excretando a bactéria.
Tabela 1. Porcentagem de abortos examinados em laboratórios de diagnóstico, com identificação do agente infeccioso.
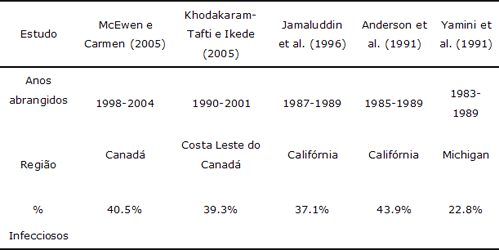
Causas Infecciosas Comuns de Abortos em Bovinos
Diversos agentes infecciosos foram identificados como causas potenciais de abortos em bovinos. Os agentes virais mais importantes são os vírus da diarreia bovina a vírus (BVD) e da rinotraqueíte infecciosa bovina (IBR). Os principais agentes bacterianos associados ao aborto bovino incluem Leptospirosis spp., Campylobacter fetus e Brucella abortus. Outras bactérias, tais como Chlamydia, Haemophilus somnus, Mycoplasma spp, Anaplasmosis, Listeria monocytogenes, Salmonella spp e Archanobacterium pyogenes, também foram relacionados ao aborto bovino. O Trichomoniasis e o Neospora caninum são parasitas causadores de perdas reprodutivas. Finalmente, várias espécies micóticas foram associadas à ocorrência de abortos esporádicos em bovinos. Três das causas infecciosas mais comumente diagnosticadas em perdas reprodutivas, o BVD, a Leptospirosis spp. e o Neospora caninum, serão discutidas em maior detalhe no texto abaixo.
Controle das Causas Infecciosas de Perdas Reprodutivas
O controle de doenças infecciosas geralmente envolve um ataque em diversas frentes. O primeiro passo é a redução da exposição aos patógenos em si. O conhecimento dos reservatórios de patógenos específicos é fundamental. Por exemplo, no caso do BVD, o reservatório primário são bovinos persistentemente infectados pelo vírus. A detecção e eliminação deste reservatório é um ponto crítico de controle na redução das perdas reprodutivas causadas pelo BVD. O segundo passo é a melhora da resposta imune dos animais aos patógenos, de forma que, caso a exposição ocorra, a probabilidade de ocorrência de patologia reprodutiva seja menor. A melhora da imunidade envolve a manutenção dos animais em bom estado de saúde geral, por meio do manejo nutricional e ambiental. Além disso, o desenvolvimento de respostas imunes específicas, através da implementação de um programa adequado de vacinação, é benéfico. As vacinas e o momento da vacinação têm que ser escolhidos com base no conhecimento profundo da patogênese da doença e das limitações das vacinas utilizadas. Também é importante lembrar que as vacinas não são 100% eficazes, devendo, portanto, ser utilizadas junto com outras medidas de controle. Finalmente, medidas adequadas de biocontenção precisam ser implementadas para reduzir a introdução e o aumento do número de patógenos. Tais medidas podem ir desde o controle da movimentação de animais, até os testes laboratoriais para a identificação da doença e a desinfecção adequada.
Literatura Citada
Anderson, M., P. Blanchard, C. Barr, and R. Hoffman. 1990. A survey of causes of bovine abortion occurring in the San Joaquin Valley, California. J. Vet. Diagn. Invest. 2:283-287.
Anderson M.L., C.W. Palmer, M.C. Thurmond, et al. 1995. Evaluation of abortions in cattle attributable to neosporosis in selected dairy herds in California. J. Am. Vet. Med. Assoc. 207:1206-210.
Anderson, M.L., J.P. Reynolds, J.D. Rowe, et al. 1997. Evidence of vertical transmission of Neospora sp infection in dairy cattle. J. Am. Vet. Med. Assoc. 210:1169-1172.
Baker, J.C. 1995. The clinical manifestations of bovine viral diarrhea infection. Vet. Clin. North Am. Food Anim. Pract. 11:425-445.
Braun, R.K., B.I. Osburn, and J.W. Kendrick. 1973. Immunologic response of bovine fetus to bovine viral diarrhea virus. Am. J. Vet. Res. 34:1127-1132.
Casaro, A.P., J.W. Kendrick, and P.C. Kennedy. 1971. Response of the bovine fetus to bovine viral diarrhea-mucosal disease virus. Am. J. Vet. Res. 32:1543-1562.
Castrucci G., F. Frigeri, B.I. Osburn, M. Ferrari, M.M. Sawyer, and V. Aldrovandi. 1990. A study of some pathogenetic aspects of bovine viral diarrhea virus infection. Comp. Immunol. Microbiol. Infect. Dis. 13:41-49.
Coria M.F., and A.W. McClurkin. 1978. Specific immune tolerance in an apparently healthy bull persistently infected with bovine viral diarrhea virus. J Am. Vet. Med. Assoc. 172:449-451.
Dhaliwal, G.S., R.D. Murray, and W.A. Ellis. 1996a. Reproductive performance of dairy herds infected with Leptospira interrogans serovar hardjo relative to the year of diagnosis. Vet. Rec. 138:272-276.
Dhaliwal, G.S., R.D. Murray, H. Dobson, J. Montgomery, and W.A. Ellis. 1996b. Reduced conception rates in dairy cattle associated with serological evidence of Leptospira interrogans serovar Hardjo infection. Vet. Rec. 139:110-114.
Done, J., S. Terlecki, C. Richardson, et al. 1980. Bovine virus diarrhea-mucosal disease virus: Pathogenicity for the fetal calf following maternal infection. Vet. Rec. 106:473-479.
Donis, R.O., and E.J. Dubovi. 1987. Molecular specificity of the antibody responses of cattle naturally and experimentally infected with cytopathic and noncytopathic bovine viral diarrhea virus biotypes. Am. J. Vet. Res. 48:1549-1554.
Dubey, J.P. 2003. Neosporosis in cattle. J. Parasitol. 89(Supp):S49-62.
Dubey, J.P. 2005. Neosporosis in cattle. Vet. Clin. North Am. Food Anim. Pract. 21:473-483.
Ellis, W.A., J.J. O´Brien, D.G. Bryson, and D.P. Mackie. 1985. Bovine leptospirosis: some clinical features of serovar Hardjo infection. Vet. Rec. 117:101-104.
Ellis, W.A., J.G. Songer, J. Montgomery, and J.A. Cassells. 1986. Prevalence of Leptospira interrogans serovar hardjo in the genital and urinary tracts of non-pregnant cattle. Vet. Rec. 118:11-13.
Evermann J.F and Ridpath J.F. 2002. Clinical and epidemiologic observations of bovine viral diarrhea virus in the northwestern United States. Vet Microbiol. 89:129-139.
Feuz, D.M., and W.J. Umberger. 2003. Beef cow-calf production. Vet. Clin. North Am. Food Anim. Pract. 19:339-363.
Gondim L.F., L. Gao, and M.M. McAllister. 2002. Improved production of Neospora caninum oocysts, cyclical oral transmission between dogs and cattle, and in vitro isolation from oocysts, J. Parasitol. 88:1159-1163.
Gondim, L.F., M.M. McAllister, W.C. Pitt, and D.E. Zemlicka. 2004. Coyotes (Canis latrans) are definitive hosts of Neospora caninum. Int. J. Parasitol. 34:159-161.
Grooms D.L. and Bolin C.A. 2005. Diagnosis of fetal loss caused by bovine viral diarrhea virus and Leptospira spp. Vet Clin North Am Food Anim Pract. 21:463-472.
Grooms, D.L. 2004. Reproductive consequences of infection with bovine viral diarrhea virus. Vet. Clin. North Am. Food Anim. Pract. 20:5-19.
Guitian, J., M.C. Thurmond, and S.K. Hietala. 1999. Infertility and abortion among first-lactation dairy cows seropositive or seronegative for Leptospira interrogans serovar hardjo. J. Am. Vet. Med. Assoc. 215:515-518.
Jamaluddin, A.A., J.T. Case, D.W. Hird, et al. 1996. Dairy cattle abortion in California: evaluation of diagnostic laboratory data. J. Vet. Diagn. Invest. 8:210-218.
Jerrett, I.V., S. McOrist, J. Waddington, et al. 1984. Diagnostic studies of the fetus, placenta and maternal blood from 265 bovine abortions. Cornell Vet. 74:8-20.
Khodakaram-Tafti, A., B.O. Ikede. 2005. A retrospective study of sporadic bovine abortions, stillbirths, and neonatal abnormalities in Atlantic Canada, from 1990 to 2001. Can. Vet. J. 46:635-637.
Kirkland, P., M. McGowan, and S. Mackintosh. 1993. Factors influencing the development of persistent infection of cattle with pestivirus. The 2nd Symposium on Pestiviruses. Lyon, France 117-121.
Kirkbride, C.A., and M. W. Johnson. 1989. Serological examination of aborted ovine and bovine fetal fluids for the diagnosis of border disease, bluetongue, bovine viral diarrhea and leptospirosis infections. J. Vet. Diagn. Invest. 1:132-138.
Kirkbride, C.A. 1992a. Viral agents and associated lesions detected in a 10-year study of bovine abortions and stillbirths. J. Vet. Diagn. Invest. 4:374-379.
Kirkbride, C.A. 1992b. Etiologic agents detected in a 10-year study of bovine abortions and stillbirths. J. Vet. Diagn. Invest. 4:175-180.
Leonard, F.C, P.J. Quinn, W.A. Ellis, and K. O´Farrell. 1992. Duration of urinary excretion of leptospires by cattle naturally or experimentally infected with Leptospira interrogans serovar hardjo. Vet. Rec. 131:435-439.
Levett, P.N. 2001. Leptospirosis. Clin. Microbiol. Rev. 14:296-326.
McAllister, M.M., J.P. Dubey, D.S. Lindsay, et al. 1998. Dogs are definitive hosts of Neospora caninum. Int. J. Parasitol. 28:1473-1478.
McEwen B. and Carman S. 2005. Animal health laboratory reports--cattle. Bovine abortion [, 1998-2004. Can Vet J. 46:46.
McClurkin, A.W., E.T. Littledike, R.C. Cutlip, et al. 1984. Production of cattle immunotolerant to bovine viral diarrhea virus. Can. J. Comp. Med. 48:156-161.
Munoz-Zanzi, C.A., S.K. Hietala, M.C. Thurmond, and W.O. Johnson. 2003a. Quantification, risk factors, and health impact of natural congenital infection with bovine viral diarrhea virus in dairy calves. Am. J. Vet. Res. 64:358-365.
Munoz-Zanzi, C.A., S.K. Hietala, M.C. Thurmond, and W.O. Johnson. 2003b. Quantification, risk factors, and health impact of natural congenital infection with bovine viral diarrhea virus in dairy calves. Am. J. Vet. Res. 64:358-365.
Olafson, P., A. MaCallum, and F. Fox. 1946. An apparently new transmissable disease of cattle. Cornell Vet. 36:205-213.
Prescott, J.F., R.B. Miller, V.M. Nicholson, et al. 1989. Seroprevalence and association with abortions of leptospirosis in cattle in Ontario. Can. J. Vet. Res. 52:210-215.
Roeder, P., M. Jeffrey, and M. Cranwell. 1986. Pestivirus fetopathogenicity in cattle: Changing sequella with fetal maturation. Vet. Rec. 118:44-48.
Sprecher, D., J. Baker, R. Holland, and B. Yamini. 1991. An outbreak of fetal and neonatal losses associated with the diagnosis of bovine viral diarrhea virus in a dairy herd. Theriogenology 36:567-606.
Wolf, C.A. 2003. The economics of dairy production. Vet. Clin. North Am. Food Anim. Pract. 19:271-293.
Yamini, B., A. Trapp, and T. Mullaney. 1990. Abortions in bovine, ovine and caprine: 1,038 cases (1983-1989). 33rd Annual Meeting of the American Association of Veterinary Laboratory Diagnosticians. Denver, CO; 18.
Dados inválidos!
Verifique suas credenciais e tente novamente: atente-se aos caracteres em
maiúsculo e minúsculo.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
Acesso a matérias, novidades por newsletter, interação com as notícias e muito mais.
ENTRAR SOU UM NOVO USUÁRIO













