Soros lácteos, tais como o soro de queijo e o permeado de soro, são subprodutos do processamento dos derivados do leite e vêm sendo amplamente utilizados na elaboração de novos produtos, devido as suas composições de lactose, proteínas, vitaminas e sais minerais.
Além das propriedades nutricionais, as proteínas dos soros conferem propriedades tecnológicas benéficas quando utilizadas como ingredientes de alimentos (Antunes, 2003). No entanto, a lactose presente nos soros limita o consumo desses produtos por indivíduos que apresentam intolerância a este açúcar, a qual atinge cerca de 70% da população mundial adulta (Mattar e Mazo, 2010).
Em função disso, a indústria de alimentos busca o desenvolvimento de produtos com baixo teor ou livre de lactose. Assim, a hidrólise enzimática desse açúcar a partir da enzima β-galactosidase, surge como um importante processo biotecnológico com aplicação na indústria de laticínios.
Esta aplicação leva a melhoria das propriedades sensoriais e tecnológicas dos produtos finais, tais como maior doçura, maior solubilidade e redução do período de fermentação (Husain, 2010).
Além disso, a hidrólise enzimática da lactose dos soros lácteos viabiliza os processos de biorremediação e de produção de biomoléculas e biomassa empregando esses soros como meios de cultivos, uma vez que seus descartes inadequados constituem um grave problema ambiental (Koutinas et al., 2009).
As β-galactosidases usadas em escala industrial devem ser provenientes de microrganismos Generally Recognized as Safe (GRAS). As características importantes para uso da enzima em processos industriais são a termoestabilidade e a elevada atividade enzimática a baixa temperatura, possibilitando sua aplicação em condições que não alteram as características sensoriais e nutricionais do leite e de seus derivados (Husain, 2010; Mlichová e Rosenberg, 2006).
Nesse contexto, o objetivo desse trabalho foi avaliar a influência da concentração enzimática, da temperatura e do tempo de reação no processo de hidrólise da lactose presente no soro de queijo e no permeado de soro empregando duas β-galactosidases comerciais de origem microbiana.
O soro de queijo e o permeado de soro em pó foram reconstituídos a 5% (m/v) de lactose. Os processos de hidrólise enzimática foram realizados empregando concentrações de 3, 6 e 9 U/mL da β-galactosidase de Aspergillus oryzae ou de Kluyveromyces lactis nas temperaturas de 10 e 55 °C para a enzima de A. oryzae e de 10 e 37 °C para a β-galactosidase de K. lactis.
Após 0, 1, 2, 4, 8 e 12 horas de reação de hidrólise coletaram-se amostras que foram submetidas a aquecimento a 100 °C em banho-maria por 10 minutos para inativação da enzima e após determinou-se a concentração de glicose através do kit enzimático Bioliquid.
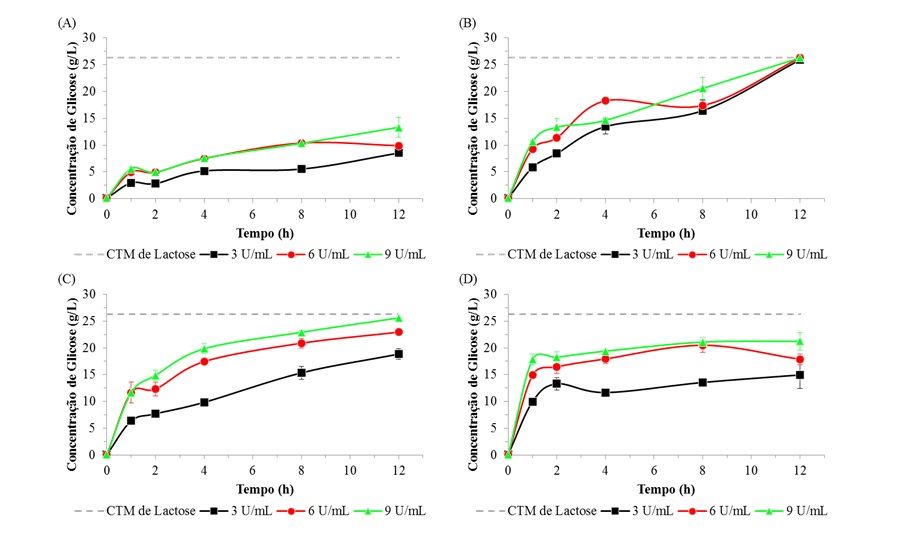
As figuras 1 e 2 apresentam os resultados de hidrólise da lactose do soro e do permeado, respectivamente, pelas enzimas de A. oryzae (10 e 55 °C) e de K. lactis (10 e 37 °C) ao longo das 12 horas de reação.
Os processos de hidrólise da lactose do soro e do permeado foram realizados em baixa temperatura (10 ºC) para ambas as enzimas, visando não alterar as características sensoriais e nutricionais dos soros lácteos. Também foi avaliado o efeito da temperatura ótima de atividade enzimática de cada uma das β-galactosidases comerciais, A. oryzae (55 °C) e K. lactis (37 °C), no processo de hidrólise.
As figuras 1 e 2 mostram que a hidrólise da lactose do soro e do permeado pela enzima de A. oryzae foi superior na temperatura ótima em relação à de 10 °C, já para a enzima de K. lactis as concentrações de glicose geradas a partir da hidrólise da lactose são semelhantes em ambas as temperaturas (10 e 37 °C), independente da matéria-prima.
Figura 1. Concentrações de glicose resultantes da hidrólise enzimática da lactose do soro de queijo pelas enzimas β-galactosidases de A. oryzae: (a) 10 °C, (b) 55 °C e de K. lactis: (c) 10 °C, (d) 37 °C. A linha pontilhada em cada gráfico indica a concentração de glicose correspondente à conversão teórica máxima de lactose (CTM).
Figura 2. Concentrações de glicose resultantes da hidrólise enzimática da lactose do permeado de soro pelas enzimas β-galactosidases de A. oryzae: (a) 10 °C, (b) 55 °C e de K. lactis: (c) 10 °C, (d) 37 °C. A linha pontilhada em cada gráfico indica a concentração de glicose correspondente à conversão teórica máxima de lactose (CTM).
Em relação à concentração da enzima empregada no processo de hidrólise, verificou-se que a variação desse parâmetro teve uma maior influência quando utilizada a β-galactosidase de A. oryzae, independente da matéria-prima estudada.
Para a enzima de K. lactis, os resultados de hidrólise da lactose apresentaram o mesmo comportamento da β-galactosidase de A. oryzae apenas quando utilizado o permeado como substrato. Para o soro os resultados de hidrólise foram semelhantes, independente da concentração da enzima de K. lactis testada.
A concentração da enzima influencia diretamente na hidrólise da lactose, como já observado em outros trabalhos (Horner et al., 2011; Akgül et al., 2012). Horner et al. (2011) avaliaram a hidrólise da lactose de leite cru e pasteurizado empregando quatro β-galactosidases comerciais de Kluyveromyces na temperatura de 2 ºC durante 72 h. Os autores observaram que o aumento de quatro vezes na concentração da enzima dobrou a concentração de lactose hidrolisada no leite após 12 h de reação.
Nas figuras 1 e 2 observa-se que para a β-galactosidase de A. oryzae as concentrações de glicose aumentaram gradualmente ao longo de todo o período de hidrólise, atingindo em 12 h, na temperatura ótima, valores próximos a máxima conversão teórica da lactose.
Enquanto para a enzima de K. lactis verifica-se um aumento gradual da concentração de glicose nas primeiras duas horas de reação e após permaneceu praticamente constante ao longo do tempo de processo avaliado, atingindo valores de cerca de 20 g/L de glicose.
O grau de hidrólise obtido no presente estudo foi superior ao descrito por Haider e Husain (2009), que avaliaram o processo de hidrólise da lactose presente no soro empregando a β-galactosidase de A. oryzae, na temperatura de 37 ºC, na concentração de 0,44 U/mL. Os autores observaram uma hidrólise máxima de 70% após 3 h de reação.
Os resultados obtidos indicam que na temperatura de 10 ºC a enzima β-galactosidase de K. lactis é mais eficiente para a hidrólise da lactose presente no soro de queijo e no permeado de soro que a de A. oryzae. No entanto, nas condições de tempo de reação e concentração enzimática avaliados, não foram atingidos 100% de hidrólise da lactose utilizando a β-galactosidase de K. lactis.
A hidrólise total da lactose presente no soro e no permeado foi obtida pela enzima de A. oryzae quando empregada sua temperatura ótima (55 ºC), ao final de 12 h de reação, independente da concentração enzimática utilizada.
Referências
Akgül BF, Demirhan E, Özbeck B. 2012. A Modelling study on skimmed milk lactose hydrolysis and β-Galactosidase stability using three reactor types. Int J Dairy Technol 65:217-231.
Antunes AJ. 2003. Funcionalidade de proteínas do soro de leite bovino. São Paulo: Manole. 135p.
Haider T, Husain Q. 2009. Immobilization of β-galactosidase by bioaffinity adsorption on concanavalin A layered calcium alginate–starch hybrid beads for the hydrolysis of lactose from whey/milk. Int Dairy J 19:172–177.
Horner TW, Dunm ML, Eggett DL, Ogden LB. 2011. β-galactosidase activity of commercial lactase samples in raw and pasteurized milk at refrigerated temperatures. J Dairy Sci 94:3342-3349.
Husain Q. 2010. β-Galactosidases and their potential applications: a review. Crit Rev Biotechnol 30:41-62.
Koutinas AA, Papapostolou H, Dimitrellou D, Kopsahelis N, Katechaki E, Bekatorou A, Bosnea LA. 2009. Whey valorisation: A complete and novel technology development for dairy industry starter culture production. Bioresour Technol 100:3734–3739.
Mattar R, Mazo DFC. 2010. Intolerância à lactose: mudança de paradigmas com a biologia molecular. Rev Assoc Méd Bras 56:230-236.
Mlichová Z, Rosenberg M. 2006. Current trends of β-galactosidase application in food technology. J Food Nutrit Res 5:47-54.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS