Octaviano Alves Pereira Neto
Gerente de Contas Especiais/ TC - Beef
A Tristeza Parasitária Bovina (TPB) é um complexo hemoparasitário causado por Babesia spp e pelo Anaplasma marginale, podendo ocorrer de forma isolada ou associada no hospedeiro.
O principal vetor biológico da TPB é o Carrapato dos Bovinos (Rhipicephalus microplus), podendo no caso da anaplasmose também ocorrer devido à participação de outros hematófagos, tais como, Tabanídeos (mutucas), a Mosca dos Chifres (Haematobia irritans) e a Mosca dos Estábulos (Stomoxys calcitrans), e ainda, por via transplacentária, transfusões sanguíneas e fômites, tais como, agulhas hipodérmicas, luvas de palpação, tatuadeiras, etc... contaminadas com sangue.
As perdas produtivas associadas à TPB são impressionantes, sendo muitas vezes subestimadas pelos proprietários. Elas provocam prejuízos à saúde animal, perdas de peso, queda na produção leiteira, abortos, elevadas taxas de mortalidade, custos de tratamentos e prevenção (Reinbold et al., 2010b), afetando também o desempenho de forma subclínica, devido à depressão hematócrito (Volume Globular - VG).
Variações no aparecimento das diferentes enfermidades impactam na escolha do protocolo de tratamento adequado, sendo necessária sua interpretação frente à complexidade do quadro, sua prevenção e controle.
Susceptibilidade dos bovinos à Tristeza Parasitária
Tanto o Bos taurus (gado europeu) como o B. indicus (gado zebu) têm semelhante predisposição à TPB, porém a maior resistência dos zebuínos aos carrapatos corrobora para a menor ocorrência de surtos de doença nesta espécie (Bock et al. 2004; Radostis et al. 2007b). A maior resistência é fruto de um longo processo de evolutivo e de adaptação do zebuíno aos ambientes de maior desafio (seleção natural).
A predisposição também está relacionada à infestação ambiental. Locais onde o desafio é mínimo (<12%) ou acentuado (>80%) são denominados de “Áreas Estabilidade Enzoótica”, nas quais a imunidade é ausente (1º caso, já que não há desafio) ou consistente e protetora (quando há desafio constante), sendo raros ou ausentes episódios clínicos (Sacco, 2002; Bock et al. 2004). Quando ocorre Instabilidade Enzoótica (flutuação na imunidade) surgem surtos da doença e riscos maiores de perdas (QUADRO 1).
Quadro 1. Porcentagem de animais com anticorpos específicos aos nove meses de idade (Sacco, 2002)
|
Sensibilidade |
Condição de risco |
Prognóstico |
|
<12% |
Estabilidade enzoótica |
Surtos pouco prováveis – se acontecer grande prejuízo |
|
> 12% e <80% |
Instabilidade enzoótica |
Situação máxima de risco |
|
>80% |
Estabilidade enzoótica |
Surtos pouco prováveis – quando ocorrem são discretos |

Bezerros, filhos de vacas com boa imunidade ativa, adquirem anticorpos através do colostro, ficando protegidos por 3 a 4 meses pós-nascimento. Entre os 6 e 12 meses os riscos da babesiose são extremos (Radostis et al. 2007b). O colostro é uma ferramenta de prevenção nas fases jovens, porém muitas vezes as vacas leiteiras confinadas também não tem imunidade adequada, havendo pouca imunidade passiva.
Fatores nutricionais, resistência inata e nível de infestação do carrapato, podem determinar a ocorrência maior ou menor dos surtos, devendo ser alvo de preocupação e ações de manejo por parte dos produtores.
Entendendo a doença
Os sintomas clássicos da TPB são febre alta e anemia, porém é possível observar variações conforme o agente envolvido. Na Babesiose, a hemólise (destruição das hemácias) ocorre dentro do leito vascular (Bock et al. 2004), levando a liberação de hemoglobina e observação de urina escura (cor de café), enquanto na Anaplasmose as hemácias parasitadas são removidas no baço, causando hipertrofia do órgão (esplenomegalia) e a liberando a bilirrubina na corrente sanguínea com icterícia nas mucosas, serosas e gordura corporal. A perda de hemácias leva à hipóxia, anóxia e morte do animal (Radostis et al., 2007b). Esse quadro anêmico leva muitos produtos a equivocadamente administrar ferrodextrano, porém NÃO HÁ NECESSIDADE (não se trata de anemia ferropriva), ao contrário, todo o Fe+ liberado das hemácias está acumulado no fígado e essa suplementação pode agravar o quadro tóxico.
Apesar de frequentemente associadas e sem a existência de um diagnóstico clínico diferencial por parte dos envolvidos na resolução do problema é importante entender como cada uma das enfermidades ocorre:
a) Babesiose – causada por um protozoário com transmissão pelo carrapato do bovino
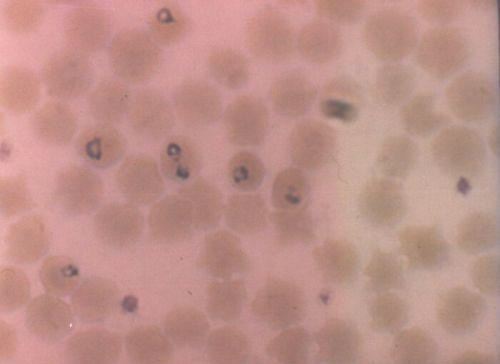
A Babesiose ocorre em diversos países de clima tropical e subtropical, entre os paralelos 40ºN e 32ºS, nos quais o principal vetor é o carrapato R. microplus. No hospedeiro, a Babesia spp parasita apenas hemácias (Radostis et al. 2007b), causando sua destruição no leito vascular e liberando mais agentes no sangue, que infectarão outras hemácias. Pode haver até 80% células parasitadas.
Nem todo carrapato é portador de Babesia spp, (Bock et al. 2004), porém apenas um é o suficiente para contaminar um bovino e, a partir da parasitemia, contaminar outros carrapatos (transestadial). Ao ser ingerido pelo carrapato, o parasita abandona a hemácia e atravessa as células epiteliais do intestino do parasito, migrando através da hemolinfa até atingir, colonizar e se multiplicar nas glândulas salivares. Serão, então, injetados novamente na forma de esporozoítos através da saliva do carrapato, durante sua alimentação. A presença de antiinflamatórios e anticoagulantes, mesclados à saliva, favorecem esse processo de difusão. A outra forma de disseminação, denominada transovariana, ocorre pela migração dos parasitos até os ovários da teleóginas, de modo que os ovos já eclodirão como portadores de esporozoítos da Babesia spp e as larvas e ninfas já irão transmitir, tão logo iniciem seu parasitismo (Chauvin et al., 2009).
Um elemento epidemiológico importante é que a B. bovis é transmitida pelas larvas do carrapato, enquanto que a B. bigemina pelas ninfas e adultos. Isso gera surtos precoces, antes mesmo que o produtor perceba uma infestação intensa, pois surge antes da visualização das teleóginas.
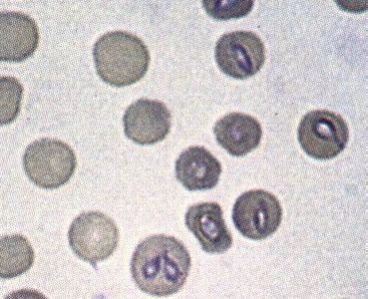
Dentre as espécies relevantes, a B. bovis (A) é a mais patogênica, liberando fatores vasoativos e de coagulação sanguínea (Radostis et al. 2007b), que provocam a Babesiose Cerebral, com sintomas nervosos (Rodrigues et al. 2005), e, ainda, falhas renal e pulmonar (Brown et al. 2006). Esse quadro pode surgir sem alterações graves na volemia, ou mesmo apresentando baixas cargas parasitárias e infestação de carrapato, confundindo seu diagnóstico. Já a B. bigemina (B) causa severa destruição eritrocitária, com a liberação de hemoglobina na urina (hemoglobinúria).
Figura A
Figura B
Imunidade contra a babesiose envolve tanto mecanismos inatos quanto adquiridos (Bock et al. 2004), sendo uma resposta humoral e celular dependentes das células-T. Animais que sobrevivem, desenvolvem resposta imune contra a doença, mas não contra a infecção e se o desafio for constante, a imunidade é permanente (Radostis et al. 2007b), entretanto, métodos que provocam supressão do contato com o carrapato promovem o declínio da imunidade rapidamente, causando instabilidade enzoótica (reduz a exposição ao agente) e riscos de novos surtos quando desafiados (Vieira et al. 2003).
b) Anaplasmose e seus impactos – um problema em ascensão
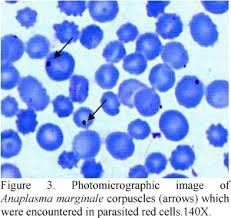
O A. marginale contamina tanto hospedeiros alvo quanto vetores não infectados, os quais após ingerirem hemácias parasitadas acabam por multiplicar o agente nas glândulas salivares, inoculando-os dai por diante através da saliva durante sua picada. Na corrente sanguínea do hospedeiro, infectarão novas hemácias, formando 4 a 8 novos indivíduos a cada passagem pela hemácia, chegando a infectar 70% das hemácias do hospedeiro (Kocan et al. 2003). O período de incubação varia entre 20 e 60 dias.
Uma via iatrogênica (mecânica) através de agulhas hipodérmicas contaminadas é comum. Reinbold et al. (2010b) observaram que uma agulha contaminada foi suficiente para infectar 6 bezerros em 10 vacinados, na sequencia, demonstrando que não apenas o controle do parasitismo deve ser adotado para prevenir surtos de anaplasmose ou a contaminação dos bovinos em lotes contemporâneos.
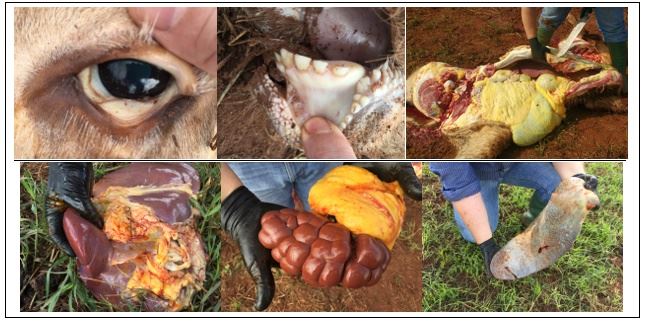
Os achados clínicos da anaplasmose são mucosa ocular, gengival e vulvar bem anêmicas e ictéricas. Na necropsia, o fígado está aumentado de tamanho, escurecido, friável, sangue aquoso, vesícula biliar aumentada e a bile espessa, baço aumentando de tamanho, rins congestos, coração com hemorragias (equimoses) no epicárdio, endocárdio e pericárdio, ascite, hidrotórax, hidropericárdio e edemas (FIGURA 2).
Figura 2 – Necropsia de um caso típico de anaplasmose bovina. (A) anemia com mucosa ictérica; (B) anemia profunda; (C) icterícia na carcaça; (D) hepatomegalia com bordas espessas; (E) congestão renal e gordura Perirrenal ictérica; (F) esplenomegalia. Fotos: Octaviano Pereira (2016).
Bovinos que sobrevivem à anaplasmose tornam-se portadores permanentemente infectados, caracterizando-se por repetidos ciclos de ricketsemia (multiplicação do agente no sangue) a cada cinco semanas. Estes indivíduos são responsáveis pela transmissão horizontal, vertical e iatrogênica aos novos ingressantes ao rebanho (Reinbold et al.,2010a), correspondendo ao reservatório de sangue contaminado para a infecção biológica, mecânica ou intrauterina.
Como diagnosticar a Tristeza Parasitária
Alguns sintomas clínicos são clássicos nos quadros de TPB, sendo diferenciais os achados:
- Babesia bovis – sintomatologia nervoso por comprometimento de capilares cerebrais
- Babesia bigemina – presença de hemoglobinúria (urina escura) por hemólise intravascular
- Anaplasma marginale – pigmentação de mucosas por bilirrubina (icterícia).
Apesar de apresentar sintomas clássicos e bastante conhecidos de produtores, peões e profissionais da área, o diagnóstico diferencial é importante, sendo baseado na epidemiologia e estudo do quadro clínico, em especial para leptospirose, hemoglobinúria bacilar, hematúria enzoótica e hemoglobinúria pós-parto (Radostis et al. 2007a). Podem ser doenças concomitantes ou diversas, causando surtos inadvertidamente.
Esfregaços devem ser feitos com uma gota de sangue estendida em lâmina e seca ao ar (vide figura ao lado), fixada em metanol e corada pela Técnica de Giemsa. Sua observação em microscopia de imersão permite a visualização das estruturas parasitárias nas hemácias e o reconhecimento do agente envolvido.
Sangue da borda da orelha ou ponta da cauda são ideais para capturar hemácias contendo B. bovis. Não dispondo de métodos adequados, envie sangue da jugular com EDTA para o laboratório, porém o sucesso no diagnóstico demandará de uma maior parasitemia para detectar o agente intraeritrocitário.
Ainda há carência de métodos laboratoriais eficazes e disponíveis em muitas regiões, podendo ser empregadas técnicas como a visualização do parasitismo nas hemácias, ou métodos como o PCR (Polimerase Chain Reaction) para detectar a presença do agente e o ELISA (Enzyme-Linked Immunosorbent Assay). No Quadro 1 se vê os diferentes objetivos e alvos de cada técnica.
QUADRO 1. Diferentes métodos diagnósticos empregados para análise de animais e rebanhos para avaliação de exposição prévia ao Anaplasma marginale. Adaptado de OIE (2015).
|
Método |
Avaliação |
Propósito adotado (vide legenda abaixo) |
||||
|
A |
B |
C |
D |
E |
||
|
Microscopia ótica |
Agente |
- |
- |
- |
+++ |
- |
|
PCR |
Agente |
- |
+++ |
- |
+++ |
- |
|
ELISA |
Anticorpos |
+++ |
+ |
+++ |
- |
+++ |
|
IFAT |
Anticorpos |
+ |
- |
- |
- |
++ |
LEGENDA: A – População livre da infecção; B – Indivíduos livres antes de movimentar; C – Tentativa de Erradicação; D - Confirmação clínica da doença; E - Prevalência da infecção, sobrevivência; F - Estado imunitário pós-vacinação.
Tratamento e Prevenção da Tristeza Parasitária Bovina

A oxitetraciclina não afeta a formação da imunidade adquirida, porém o animal permanece como portador (Coetzee et al., 2005; Kocan et al. 2010). A dose de oxitetraciclina recomendada seria 6 a 10mg/kg durante 24x24h, durante três dias ou, 20mg/kg de PV em dose única, por via intramuscular, com efeito bacteriostático. Atif et al. (2012) testaram um regime aplicações de oxitetraciclina na de 22mg/kg, IV, durante 5 dias, tendo observado sucesso na quimioesterilização, porém há dúvidas sobre a veracidade de resultados de muitos trabalhos semelhantes (falso negativos), pois se usou o Teste de Fixação de Complemento para evidenciar negativos, quando o adequado seria o teste de ELISA (Kocan et al., 2010).
O uso de anti-inflamatórios não esteroides (AINE), tais como Antipirina, Piroxicam ou Diclofenaco Sódico, permite combater o quadro de hipertermia, comum na TPB.
Parte do sucesso na prevenção de surtos está no correto controle do Carrapato (R. microplus), portanto, o emprego de programas de controle envolvendo AcatakTM e o MegamectinTM contribuem para atenuar o desafio parasitário, tanto pela redução da carga parasitária que inocula os agentes da TPB, como pelos efeitos deletérios do parasitismo per se sobre à saúde do animal.
As vacinas de alta eficácia ainda são uma expectativa para o futuro, portanto, prevenir a Tristeza Parasitária Bovina passa por conhecer profundamente a doença, mas especialmente, na qualidade dos programas de controle de parasitos e prevenção da transmissão através de boas práticas de manejo na rotina da fazenda.
Referências consultadas (à disposição dos interessados)
ATIF et al. 2012 Pakistan J. Zool. 44.2:449-456
BOCK et al. 2004 Parasitol, 129: S247–S269.
BROWN et al. 2006 Vet. Parasitol., 138.1-2:76-87
CHAUVIN et al. 2009 Vet Res. 40.1:37-54
COETZEE et al. 2005 Vet. Parasitol. 127.1: 61–73.
KOCAN et al. 2003 Clin Microbiol Rev. 16.4: 698–712
KOCAN et al. 2010 Vet. Parasitol. 167.1: 95–107
OIE 2015 <https://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.04.01_BOVINE_ANAPLASMOSIS.pdf> 05/07/2016
RADOSTIS et al. 2007a Veterinary Medicine 8th Ed., p. 1455-1459
RADOSTIS et al. 2007b Veterinary Medicine 8th Ed., p. 1483-1498
REINBOLD et al. 2010a. Vet Microbiol 145.1: 69–75
REINBOLD et al. 2010b . Am. J. Vet. Res. 71.10:1178-1188
RODRIGUES et al. 2005 Ciência Rural, 35.1:121-125,
SACCO, A.M. 2002 Circular Técnica 28, Embrapa, 12 p.
Elanco, Ganaseg, Acatak, Megamectin e a barra diagonal são marcas da Elanco Saúde Animal e suas afiliadas.
Para maiores informações consulte a bula do produto.
* Os animais não devem ser abatidos para o consumo humano antes de transcorridos 28 dias após o último tratamento.
** Não usar em vacas leiteiras, as quais o leite seja destinado ao consumo humano.
Código BRCTLGNS00007

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS