Levando em consideração que os bezerros nascem com baixíssimas concentrações de anticorpos, devido às características placentárias das vacas, garantir uma colostragem eficiente é fundamental para que se obtenha sucesso na criação. Esse fato já foi comprovado por diversos estudos que demonstraram redução nas taxas de morbidade e mortalidade de bezerros que tiveram transferência de imunidade passiva (TIP) bem-sucedida.
Além desses efeitos de curto prazo, o maior fornecimento de colostro e o possível aumento na eficiência da TIP já foi associado também a maior ganho médio diário em novilhas e maior produção de leite nas duas primeiras lactações (Faber et al., 2005).
Tendo em vista os impactos da colostragem ao longo da vida produtiva dos bovinos, o monitoramento dos dados de TIP, de forma a otimizar este manejo deve ser parte integrante da criação de fêmeas de reposição. Esta avaliação é realizada nos primeiros dias de vida através da mensuração das concentrações séricas de imunoglobulinas, especialmente a imunoglobulina G (IgG). Com base no valor sérico de IgG (mg/mL) obtido, os bezerros podem ser classificados em 4 categorias: excelente (≥25,0), bom (18,0 – 24,9), regular (10,0 – 17,9) ou ruim (<10,0), sendo esta última categoria correspondente a animais com falhas na TIP (FTIP).
Esses valores listados acima são considerados quando utilizamos métodos diretos de avaliação da TIP, como a imunodifusão radial, a qual é considerada o padrão ouro de avaliação de IgG sérica e colostral. No entanto, dentro da porteira são utilizados métodos indiretos para detecção de FTIP, como a avaliação através do refratômetro de Brix, sendo este um método de análise amplamente aceito e que fornece resultados confiáveis quando os bezerros são colostrados com colostro materno (Deelen et al 2014).
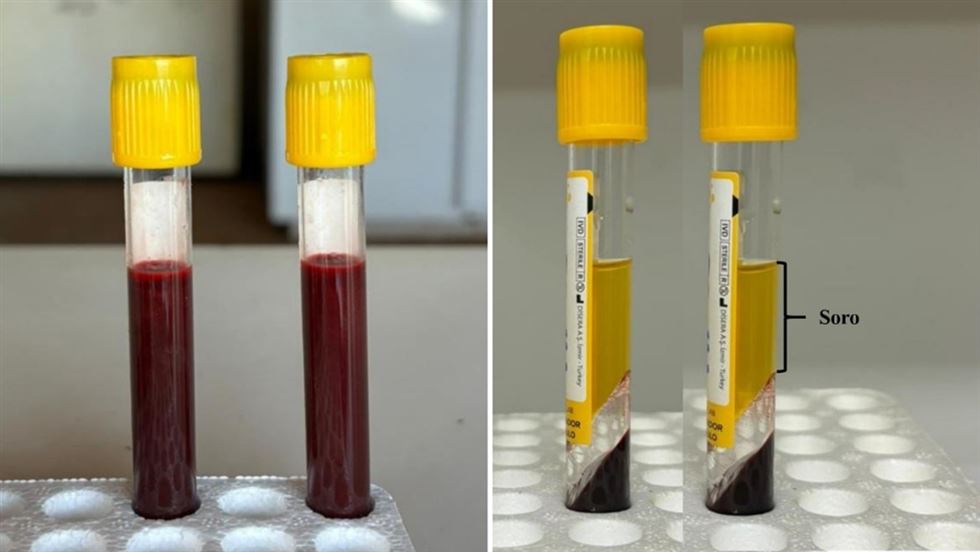
A determinação da concentração de IgG, para avaliação da TIP, se dá no soro dos animais. Para isso, uma amostra de sangue é coletada e o soro obtido normalmente por centrifugação (Figura 1). Entretanto, em muitas situações, por questão de praticidade e/ou falta de uma centrífuga, o sangue coletado é deixado em temperatura ambiente para coagular, havendo assim a separação do soro (Figura 2). Além desta alternativa, há possibilidade de utilizar um sistema de filtro descartável para avaliar amostras de sangue imediatamente após a coleta (Sutter et al., 2020).
Figura 1. Soro obtido por centrifugação.
Sangue recentemente coletado (à esquerda) e após centrifugação (à direita)
Figura 2. Separação do soro por coagulação.
Sangue recentemente coletado (à esquerda), durante o processo de coagulação (ao centro) e após 24 horas em temperatura ambiente (à direita).
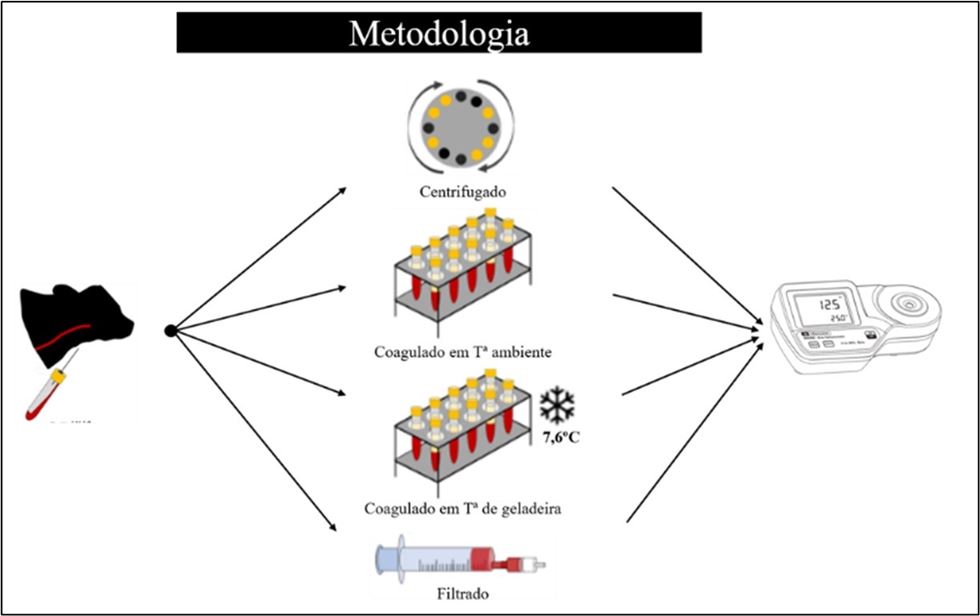
Sonntag e colaboradores (2023) realizaram um estudo na Alemanha com o objetivo de comparar 4 diferentes métodos de coleta do soro para avaliação da TIP em bezerros leiteiros. Para tal, os pesquisadores utilizaram amostras de sangue de 321 bezerros holandeses com idade entre 24 horas e 7 dias de duas fazendas comerciais. Foram avaliadas 4 técnicas diferentes de coagulação sanguínea e separação do soro para posterior determinação de IgG em laboratório e Brix:
- Amostra centrifugada - centrifugação na fazenda a 4.500 × g por 10 minutos a aproximadamente 20°C, 1 a 2 horas após a coleta;
- Coagulada em temperatura ambiente – amostra deixada para coagular através da ativação por contato com a superfície do tubo por 24 horas em temperatura ambiente (aproximadamente 20ºC);
- Coagulada em temperatura de geladeira – amostra deixada para coagular através da ativação por contato com a superfície do tubo, armazenado em temperatura de geladeira (aproximadamente 8ºC) por 48 horas (pois demorava mais para as amostras de sangue coagularem) e;
- Filtrada imediatamente após a coleta utilizando filtro descartável (2-Drop-Filter, Pharmadoc).
Adaptado de Sonntag et al., (2023)
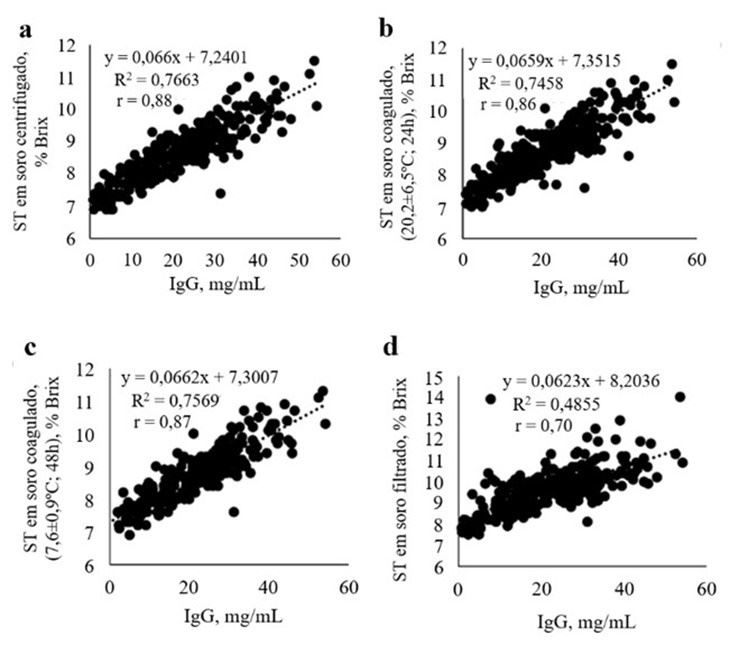
Todas as amostras de soro foram avaliadas utilizando-se um refratômetro de Brix e também através da imunodifusão radial. A concentração de IgG (mg/mL) determinada por imunodifusão radial foi plotada em relação aos resultados de refratometria para estimativa de sólidos totais (% Brix) de amostras centrifugadas, soro filtrado e coagulado (temperatura ambiente e de geladeira), conforme a Figura 3.
Figura 3.Concentração de IgG (mg/mL) determinada por imunodifusão radial, refratometria de amostras centrifugadas, soro filtrado e coagulado.
(a) Concentração de imunoglobulina G (mg/mL) em soro centrifugado avaliado por imunodifusão radial comparada com sólidos totais (ST; % Brix; r = 0,88); (b) Concentração de IgG (mg/mL) em soro coagulado em temperatura ambiente avaliado com imunodifusão radial em comparação com ST (% Brix) após ser deixado por 24 horas a 20,2 ± 6,5°C (r = 0,86); (c) Concentração de IgG (mg/mL) em soro coagulado em temperatura de geladeira avaliado com imunodifusão radial em comparação com ST (% Brix) após ser deixado por 48 horas a 7,6 ± 0,9°C (r = 0,87); (d) Concentração de IgG (mg/mL) em soro filtrado avaliado com imunodifusão radial em comparação com ST (% Brix; r = 0,70).
Nesse estudo os autores encontraram coeficiente de correlação entre as concentrações séricas de IgG medidas com imunodifusão radial e as medidas com o refratômetro de r = 0,88 para as amostras de soro centrifugado (Figura 3a). Esse valor foi semelhante ao encontrado por outros pesquisadores (Elsohaby et al., 2019). Coeficientes de correlação semelhantes foram encontrados no soro coagulado em temperatura ambiente (r = 0,86) e coagulado em temperatura de geladeira (r = 0,87; Figuras 3b e 3c). Já para as amostras de soro filtradas, a correlação foi r = 0,70 (Figura 3d).
As altas correlações encontradas nesse estudo assim como em outros, realizados anteriormente, reforçam a ideia de que tanto o soro centrifugado como aquele deixado coagular são adequados para a identificação de FTIP por meio da utilização do refratômetro de Brix.
Outro resultado interessante encontrado nesse estudo foi o tempo médio necessário para a coagulação, o qual foi de 182 minutos para as amostras armazenadas em temperatura ambiente e de 195 minutos para aquelas refrigeradas. Associada a esta informação, os autores destacaram que diversas amostras que foram armazenadas em temperatura de geladeira tiveram que ser excluídas do experimento devido à hemólise.
Uma possível justificativa para esse fato seria o resfriamento rápido antes que as amostras de soro comecem a coagular, o que causaria danos aos glóbulos vermelhos, liberando assim hemoglobina. Este pode ser um problema observado a campo e como alternativa para reduzir o risco de hemólise foi sugerido que as amostras sejam deixadas de 1 a 2 horas em temperatura ambiente, enquanto coagulam, e só depois sejam resfriadas.
Ao final deste trabalho, os autores concluíram que os 4 métodos de coleta de soro analisados foram eficientes para avaliação da TIP em bezerros. Destacando que os métodos utilizando centrifugação e coagulação (em temperatura ambiente ou refrigerado) se mostraram altamente precisos para identificar bezerros com FTPI, enquanto a precisão do teste utilizando soro filtrado foi ligeiramente menor. Este fato não descarta a possibilidade de uso do soro filtrado, no entanto, deve-se ter em mente que por vezes o uso deste proporcionará maior % Brix.
Levando em consideração esta informação e o risco aumentado de hemólise nas amostras mantidas refrigeradas, os autores recomendam que, sempre que possível, faça-se uso de soro centrifugado ou coagulado à temperatura ambiente.
Entretanto, independentemente do método de obtenção de soro ou de avaliação utilizado o mais importante é não deixar de monitorar a TIP e gerenciar estas informações afim de entender a eficiência do processo de colostragem e implementar melhorias sempre que necessário.
Gostou do conteúdo? Deixe seu like e seu comentário, isso nos ajuda a saber que conteúdos são mais interessantes para você.
Referências
Deelen, S. M., T. L. Ollivett, D. M. Haines, and K. E. Leslie. 2014. Evaluation of a Brix refractometer to estimate serum immunoglobulin G concentration in neonatal dairy calves. J. Dairy Sci. 97:3838–3844. https://doi .org/10 .3168/ jds .2014 -7939.
Elsohaby, I., J. T. McClure, L. A. Waite, M. Cameron, L. C. Heider, and G. P. Keefe. 2019. Using serum and plasma samples to assess failure of transfer of passive immunity in dairy calves. J. Dairy Sci. 102:567–577. https://doi.org/10 .3168/jds.2018 -15070.
Faber, S. N., N. E. Faber, T. C. McCauley, and R. L. Ax. 2005. Case study: Effects of colostrum ingestion on lactational performance. Prof. Anim. Sci. 21:420–425. https://doi.org/ 10 .15232/ S1080-7446(15)31240-7.
Sonntag, N., Borchardt, S., Heuwieser, W., Sargent, R., Sutter, F. 2023. Evaluating different methods of serum collection to detect failed transfer of passive immunity in newborn calves via refractometry. JDS Communications. https://doi.org/10.3168/jdsc.2022-0335.
Sutter, F., E. Rauch, M. Erhard, R. Sargent, C. Weber, W. Heuwieser, and S. Borchardt. 2020. Evaluation of different analytical methods to assess failure of passive transfer in neonatal calves. J. Dairy Sci. 103:5387–5397. https://doi .org/10 .3168/ jds .2019 -17928.
Comentários
É muito comum o entendimento que para avaliar a eficiência de colostragem através de medidas de Brix a fazenda precise ter uma centrífuga. Embora a qualidade da amostra de soro seja aumentada quando o sangue é centrifugado, deixar a amostra de sangue coagular em temperatura ambiente permite uma ótima avaliação. O trabalho mostrou que embora o número de amostras de soro não adequadas para a avaliação, devido à hemólise, aumente quando a amostra é deixada para coagulação, especialmente sob refrigeração, as amostras adequadas tem ótima correlação entre Brix medido por refratometria na fazenda e IgG medido em laboratório. Algumas propriedades tentam estratégias para improvisar a centrifugação, como prender as amostras nas pás de ventiladores, mas simplesmente deixar que o sangue coagule para obtenção do soro é mais simples e permite adequada avaliação da TIP. Não deixe de gerenciar a eficiência da colostragem, esse é o fator determinante para o sucesso na criação das bezerras.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS