Autores:
Roulber Carvalho Gomes da Silva – Médico veterinário, Mestre e Doutor em Qualidade e Produtividade Animal e Gerente de Marketing e Técnico de Grandes Animais da Boehringer Ingelheim
Eduardo Pires – Médico Veterinário, Mestre em Produção Animal Sustentável e Coordenador Técnico Especialista de Grandes Animais da Boehringer Ingelheim
Kamila Bravo – Graduanda de Medicina Veterinária e estagiária da área técnica de Grandes Animais da Boehringer Ingelheim
INTRODUÇÃO
A Diarreia Viral Bovina, mais conhecida como BVD é uma doença com alta prevalência e que causa grandes prejuízos econômico no Brasil e em rebanhos de todo o mundo, o vírus da BVD está distribuído mundialmente provocando infecções endêmicas na maioria dos países com atividade pecuária, causando significativos prejuízos econômicos para a cadeia da carne e do leite (Flores et al., 2005).
Inicialmente, a BVD era vista apenas como uma doença que causava prejuízos devido seu efeito na reprodução dos animais, porém não é apenas uma doença reprodutiva. Os prejuízos econômicos ocorrem principalmente devido à imunossupressão, morbidade e até mortalidade de animais, além de abortos, natimortos, nascimento de bezerros com mal formações congênitas e presença de animais persistentemente infectados, acarretando um impacto de aproximadamente US$210 por animal/ano segundo Richter et al. (2017), que realizou um estudo de análise econômica dos trabalhos mundialmente relacionados com a doença.
O VÍRUS DA BVD
O BVDv é um vírus pertencente à família Flaviviridae e ao gênero Pestivírus que, dentre suas características, costuma apresentar elevado grau de variabilidade antigênica. Tem formato esférico entre 40 e 60 nm de diâmetro, envelopado e com capsídeo icosaédrico, seu genoma é composto por RNA linear, fita simples, com polaridade positiva. Baseado em propriedades antigênicas e genéticas, dois grupos do vírus causador da BVD podem ser diferenciadas: BVD tipo 1 e BVD tipo 2. (Fino et al, 2012).
Os vírus do genótipo BVDV-1 abrangem a maior parte das cepas vacinais e de referência, enquanto os BVDV-2 foram identificados há mais de duas décadas em surtos de BVD aguda severa e doença hemorrágica na América do Norte (Pellerin et al. 1994, Ridpath et al. 1994). Existem diferenças entre os genótipos 1 e 2 que impactam diretamente os protocolos de diagnóstico e controle da BVD, biologicamente a principal diferença é em relação à glicoproteína que faz parte da indução de anticorpos contra o vírus, chamada de E2 (Fino et al, 2012). No Brasil os dois genótipos são quase igualmente distribuídos com frequências de 40-57% para BVDV Tipo 1 e 42 45% para BVDV tipo 2 (Weber et al, 2014).
Alguns anos atrás foi identificado um terceiro tipo de pestivírus, inicialmente chamado de BVD tipo 3, foi descoberto na Europa em soro fetal bovino importado do Brasil (Bauermann F. et al., 2013). Atualmente é classificado como outra espécie de pestívirus e chamado como Hobi-like vírus e tem sido reportado na América Latina, Europa, Tailândia e China (Decaro, 2020),
O BVDv também é classificado em dois biotipos em relação à sua capacidade citopatólogica em cultivos celulares: citopático (CP) e não-citopático (CP). O primeiro é encontrado em isolados de animais que apresentam forma grave da Doença das Mucosas e o segundo é o biotipo mais predominante no campo, maior causador das infecções agudas (Flores, et al., 2005).
O QUE CAUSA A BVD?
Entre as décadas de 60 e 70, Correa et al. fez a primeira publicação no Brasil relatando casos de doença com sinais clínicos semelhantes à BVD, identificada como Doença das Mucosas por Olafson em 1946, no Canadá. Foi em 1974 que Vidor realizou o primeiro isolamento do vírus no Brasil, a partir do sangue de um feto coletado em matadouro localizado no Rio Grande do Sul e a partir de então dados de sorologia e isolamento do BVDV no território brasileiro vêm sendo expostos em publicações (Botton, 1998).
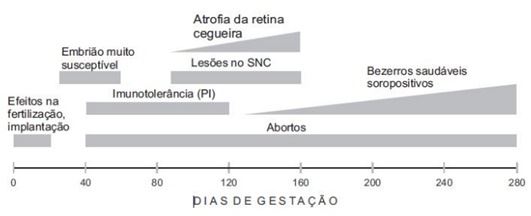
Em relação ao hospedeiro, a patogenia do vírus da BVD é dependente da sua imunocompetência e imunotolerância, além de outros fatores como a idade do animal e presença de condições estressantes (Radostits et al., 2002). A transmissão ocorre de forma horizontal através da ingestão ou inalação de partículas virais e por via sexual, e de forma vertical transplacentária. A porta de entrada são as vias nasal e oral, sendo que o vírus utiliza como sítio inicial de multiplicação as células epiteliais e tecido linfoide da boca e faringe, mais tardiamente concentram-se nas vias respiratórias, glândulas salivares e linfonodos. A eliminação do vírus é realizada pelos animais contaminados por descargas nasais, urina e saliva (Silva, 2011). Na figura abaixo de Flores e Ridpath (2017), podemos perceber o impacto da BVD nos casos de transmissão vertical. Quando a infecção ocorre entre 40 a 120 dias de gestação, teremos a formação de animais persistentemente infectados (PI’s), que nascerão imunotolerantes e eliminarão o vírus em grandes quantidades durante toda a vida.
Adaptado de Ridpath e Flores, 2007
Em relação aos sinais clínicos, os principais são lesões no trato respiratório superior, como úlceras e erosões na mucosa oral, pirexia, sialorreia, descarga nasal, tosse e diarreia sanguinolenta. Nas infecções agudas, devido a um período de imunossupressão transitória, frequentemente haverá a presença de infecções secundárias, levando ao agravamento da doença, esta é a maneira pela qual esse vírus participa no aparecimento de outras síndromes, incluindo casos de doenças entéricas e respiratórias.
O vírus da BVD também interfere extensivamente nas funções reprodutivas, nas quais, dependendo do momento da infecção, poderá ocorrer redução significativa nas taxas de concepção e aumento na incidência de abortos, malformações, natimortos ou o nascimento de animais persistentemente infectados. Devido à constante eliminação do vírus pelos animais PI, eles representam a principal fonte de disseminação do vírus no rebanho, dessa forma, sua identificação torna-se ponto fundamental em programas de controle ou erradicação da BVD (Fino et al, 2012).
PREVALÊNCIA
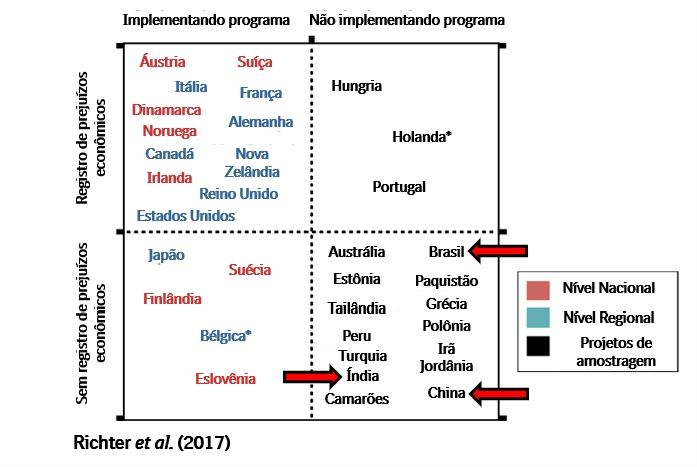
A BVD é atualmente uma das doenças mais devastadoras na pecuária de corte e leite, visto que além dos problemas causados pelo próprio vírus, possui potencial imunossupressor provocando o nascimento de bezerros fracos ou doentes, aumento dos problemas respiratórios e baixo desempenho reprodutivo no rebanho. Os dados a seguir mostram a soroprevalência (exposição ao vírus) para BVD em países importantes: Reino Unido: 90% a 95%; Irlanda: 98%; Alemanha: 60%; França: 60%; Itália: 62%; Espanha: 80%. No Brasil os valores chegam a 73% em algumas áreas (Brito et al., 2014). Um dos fatores de extrema importância para a perpetuação e a alta prevalência global é a formação dos animais PI’s. Dados de vigilância sugerem que os níveis de animais PI’s nos rebanhos em toda a Europa são: Reino Unido: 0,4-0,8%; Irlanda: 0,6%; Alemanha: 0,3%; França: 1%; Itália: 1%; Espanha: 1%; Brasil: 1,5% (Instituto Biológico, 2017). Um aspecto interessante descrito em uma pesquisa realizada na Europa, avaliando os dados da década de 1970 até o momento, é que a BVD é endêmica em todos os países onde nenhum controle sistemático foi iniciado. Sob tais condições, aproximadamente 50% de todos os rebanhos têm animais PI’s e 90% de todos os animais sofrem exposição ao vírus durante sua vida. Um fator importante a ser considerado é que os países nórdicos começaram a erradicar a BVD há mais de 10 anos, usando uma combinação de triagem, identificação de PI’s e subsequente abate, além de medidas de biossegurança. Os países nórdicos agora são classificados como livres de BVD.
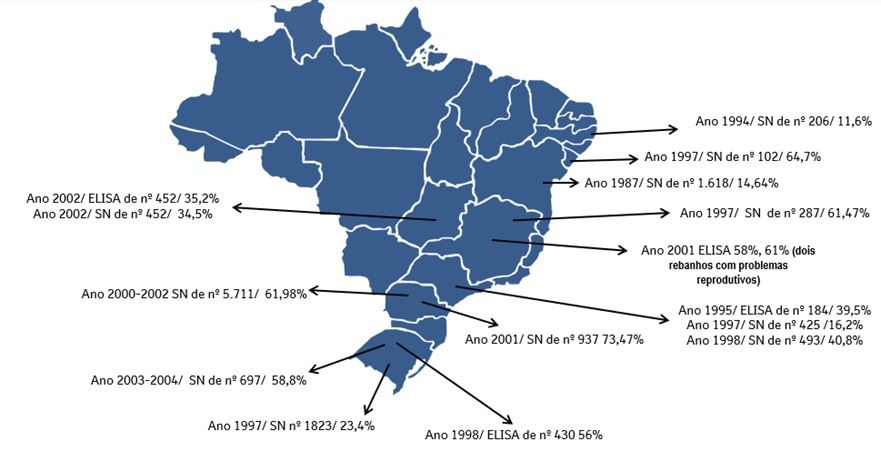
Em estudos sorológicos realizados em diferentes estados brasileiros, de 1971 a 2004 em 4.065 animais foi encontrado uma prevalência de 47,7% e na figura a seguir é possível analisar os demonstrativos de alguns estados:
(Adaptado de Flores et al., 2005)
COMO DIAGNOSTICAR A BVD?
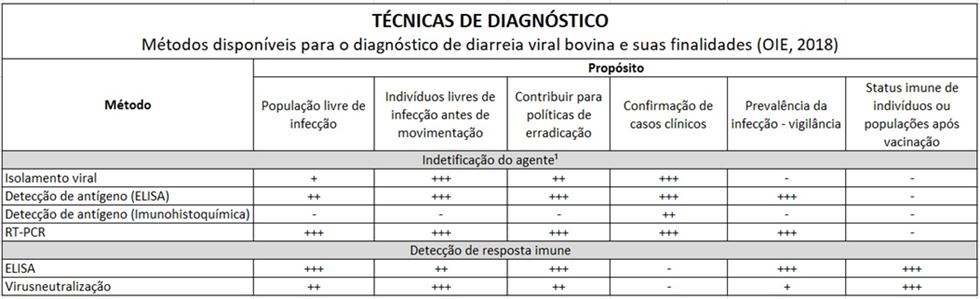
O diagnóstico laboratorial da BVD pode ser realizado através da pesquisa do vírus (antígeno) ou pesquisa de anticorpos. O isolamento viral, a partir de fragmentos de fígado, baço, mucosa do intestino delgado, sangue total, soro ou sêmen é considerado o teste de excelência para diagnóstico de BVD, mas por ter realização que demanda maior tempo, a imuno-histoquímica e ELISA estão tomando importância como métodos mais baratos e ainda assim com boa sensibilidade, permitindo a identificação de animais PI (Fino et al, 2012). Na pesquisa de anticorpos, a soroneutralização viral é rotineiramente utilizada, com esse método é possível identificar se o animal já foi exporto ao vírus em algum momento da vida, sendo esse contato com o vírus vacinal ou não. No gado leiteiro, a PCR é considerada de grande valia devido a sua alta sensibilidade, através da análise de amostras de leite coletadas em tanques (Fino et al., 2012).
¹recomendado uma combinação de métodos de identificação de agente aplicados na mesma amostra.
Legenda: +++ = método recomendado; ++ = método adequado; + = pode ser usado em algumas situações, mas o custo, a confiabilidade ou outros fatores limitam severamente sua aplicação; - = não apropriado para este propósito.
(OIE. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2018.)
É POSSÍVEL CONTROLAR A BVD?
A implementação de um programa de controle e erradicação da Diarreia Viral Bovina vem se mostrado cada vez mais importante, sendo seus pontos essenciais, além da eliminação e monitoramento de animais PI, a vacinação e os protocolos de biosseguridade. Alguns relatórios sugerem que o vírus pode circular por longos períodos (10 meses ou mais), até mesmo na ausência de animais PI identificados (Moerman et al., 1993). Em dois estudos, o vírus circulou por dois a dois anos e meio, apesar da ausência de animais PI’s ou contato direto com bovino PI (Dias, 2010). A vacinação contra BVD vem sendo indicada na proteção para o quadro clínico, redução da circulação do vírus e nascimento de animais PI’s, porém no Brasil a sua implementação ainda está lenta. Segundo Flores et al (2005), a maior utilização é em rebanhos de leite e fazendas de criação intensiva e semi-intensiva no sudeste e sul brasileiro, em comparação com a vacinação contra aftosa (aproximadamente 2,5 milhões de doses em 2003) a vacinação contra BVD foi considerada incipiente.
O monitoramento sorológico de animais PI’s é um dos pontos cruciais no controle da BVD, a partir da PCR em amostras de soro e sangue é possível fazer a identificação dos animais, separação e eliminação do rebanho o mais breve possível. Outro ponto crítico é o trânsito de animais entre propriedades, sendo importante manter protocolo de quarentena para animais recém inseridos no rebanho, principalmente fêmeas prenhes, até que sejam testados e apresentem soronegatividade. Lembrando também da importância da desinfecção das instalações em que esses animais ficarão em quarentena, além da higiene de fômites que podem transmitir horizontalmente o vírus (Fino et al., 2012).
Em regiões onde a BVD é endêmica, a vacinação de rebanhos livres é recomendada, principalmente indicada para rebanhos com alta rotatividade de animais, rebanhos com sorologia positiva, com histórico de doença clínica ou reprodutiva compatível e com confirmação virológica de BVDV (Flores et al., 2000). A vacina contra Diarreia Viral Bovina pode ser inativada (vírus morto) ou modificada (vírus vivo atenuado). As vacinas inativadas possuem partículas virais mortas, incapazes de se replicar nas células do animal, possuem maior massa antigênica diluída em adjuvantes para alcançar eficiência imunológica contra a doença. (Baccili et al., 2019). A vacina com vírus morto apresenta desvantagens como resposta imune fraca e de curta duração, proteção fetal ineficiente e revacinação periódica (Fino et al., 2012). As vacinas vivas atenuadas induzem resposta imune satisfatória e duradoura e não requer reforço após 30 dias para animais primovacinados (animais que estão recebendo a primeira dose). No cenário atual no Brasil, está disponível no mercado uma vacina viva atenuada com tecnologia patenteada de dupla deleção (Live Double Deleted – L2D), em que o vírus tem dupla deleção no genoma, levando à redução de virulência, porém, mantendo as características do genoma para melhor resposta imune.
Recentemente, uma pesquisa publicada por Schmitt–van de Leemput (2020) utilizou uma vacina viva duplamente deletada contra BVD (Bovela – Boehringer Ingelheim) e comparou a produção de leite e a performance reprodutiva de animais vacinados e não vacinados em rebanhos endemicamente infectados pela BVD, ou seja, rebanhos que não apresentavam efeitos perceptíveis da infecção, mas existia a circulação viral entre os animais. O estudo foi realizado em quatro fazendas em três países diferentes (Inglaterra, Itália e França) totalizando mais de 1450 vacas. Durante o período de 365 dias de estudo, foram coletados dados da produção diária de leite por animal, de desempenho reprodutivo e incidência de doenças. A partir das análises estatísticas, foi identificado aumento significativo na produção de leite no grupo vacinado em três das cinco fazendas. Observou-se que a produção de leite nos animais vacinados no início e meio de lactação foi de 0,61L a 1,8L a mais quando comparado às vacas não vacinadas. Essa diferença de produção foi associada principalmente ao déficit energético observado em animais infectados, devido à estimulação de produção de anticorpos e células de defesa durante a infecção. Estes resultados foram observados mesmo em rebanhos endêmicos, em que se presumia que os animais já tivessem imunidade devido à exposição prévia ao vírus.
A produção de leite foi observada em dois momentos distintos da lactação, sendo que no início de lactação (8 a 102 dias em lactação) o aumento foi de 57 L de leite por vaca e no meio da lactação (103 a 204 dias em lactação) o ganho foi de 182 L por vaca. Desta forma, se considerarmos o preço médio de R$2,33 do litro de leite no Brasil (Cepea - Outubro 2021), o ganho financeiro poderia ser de R$ 132–424 vaca/lactação.
Esse artigo tem como objetivo apresentar uma pequena revisão sobre a importância de conhecermos a BVD e demonstrar os desafios e benefícios do seu controle, mesmo em rebanhos que aparentam não ter impactos negativos devido essa enfermidade silenciosa e que causa grandes prejuízos produtivos e econômicos para os rebanhos bovinos no Brasil e no mundo.
Referências disponíveis mediante solicitação.
Ficou com dúvidas? Entre em contato pelo box abaixo:

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS