Vários estudos realizados nos últimos anos têm demonstrado e comprovado uma diminuição da eficiência reprodutiva em vacas leiteiras nos mais diversos locais do mundo e isso tem tornado o desempenho reprodutivo uma das maiores preocupações da indústria leiteira (SEEGERS, 2006). Diminuição no número de bezerros produzidos ao ano, redução na produção de leite por vaca anualmente, além de custos operacionais extras causados pelo aumento do número de serviços por concepção são exemplos que ocorrem devido ao baixo desempenho reprodutivo (SEEGERS, 2006).
Em vacas de leite problemas como enfermidades puerperais (pré e pós-parto) e metabólicas (STEVENSON e CALL, 1988), reduzem o desempenho reprodutivo e, indiretamente, a produção de leite por dia de vida útil da vaca (BRITT, 1985; FOOTE, 1975), devido a uma baixa taxa de prenhez e maior intervalo de partos.
Infecções uterinas, além de comprometerem o bem-estar animal, podem causar graves prejuízos na fertilidade dos animais e, como tal, devem ser encaradas como algo que é necessário diagnosticar e tratar. Devido ao fato da endometrite não causar repercussões sistêmicas, os efeitos são mensuráveis através de impactos na reprodução (SHELDON, 2004; Le Blanc et al., 2002). A doença uterina clínica e subclínica estão associadas com subfertilidade e infertilidade (SHELDON et al., 2008).
Devido à importância da eficiência reprodutiva para lucratividade do rebanho leiteiro e dos efeitos negativos da incidência de endometrite clínica no desempenho reprodutivo subsequente das vacas leiteiras se faz necessário a definição de uma técnica eficaz e prática para o diagnóstico da endometrite.
Um estudo foi conduzido com o objetivo de comparar a eficácia de dois métodos de diagnóstico da endometrite clínica (técnica da mão enluvada vs. vaginoscopia de imagem) e avaliar a incidência de endometrite clínica em vacas leiteiras Holandesas.
Foram realizados os exames de mão enluvada em 117 vacas Holandesas pertencentes a uma fazenda comercial, localizada no município de Uberlândia - MG, entre 30 e 90 dias pós-parto (DPP). Destas, 72 foram submetidas também ao exame de vaginoscopia de imagem. O rebanho da Fazenda avaliada é constituído de aproximadamente 450 vacas em lactação, mantidas confinadas o ano todo, recebendo dieta total devidamente balanceada.
O exame foi realizado ao final do período voluntario de espera (período definido por cada fazenda para iniciar o programa reprodutivo das vacas depois do parto). Para a coleta do muco foi utilizado um brete de contenção dos animais de forma que os mesmos fossem submetidos ao mínimo possível de estresse.
Após limpeza da vulva com papel toalha seco, o vaginoscópico de imagem (IMAGIN VET®) foi introduzido na vagina da vaca e a câmera foi guiada por uma sonda para a captura da imagem, a partir da qual foi feita a avaliação do fundo da vagina e do muco vaginal.
Em seguida foi utilizada a técnica da mão enluvada, e esta lubrificada com soro fisiológico foi colocada, através da vulva, no fundo da vagina. O conteúdo do muco da vagina foi retirado para o exame. Esse método foi validado e não provoca a contaminação bacteriana do útero, não causa uma resposta inflamatória ou atraso na involução uterina (SHELDON, et. al., 2006).
O muco vaginal foi avaliado de acordo com a cor e a proporção e volume de pus, segundo uma adaptação da classificação proposta por McDougall et al. (2007). O muco foi classificado em muco limpo ou cristalino, sem muco, muco turvo e muco purulento.
Após a coleta do muco vaginal foi feita a avaliação da condição ovariana com aparelho de ultrassom equipado com transdutor retal linear de 7,5-MHz (DP-3300vet Mindray), para determinação da presença de corpo lúteo e folículos e a avaliação da involução uterina.
Também foi feita a avaliação do escore de condição corporal, utilizando uma escala de 1 a 5 (1 - muito magra e 5 - obesa; FERGUSON et al., 1994).
A incidência de endometrite foi avaliada por regressão logística, sendo incluídos no modelo os efeitos de dias pós-parto, presença de corpo lúteo e escore de condição corporal, no programa MINITAB. A comparação entre os dois métodos de diagnostico da endometrite clínica foi realizada pelo Teste de McNemar.
Das 117 vacas examinadas com a técnica da Mão Enluvada, 13,68 % (16/117) apresentaram conteúdo muco purulento, sendo consideradas com endometrite clínica. Das vacas classificadas como sem endomentrite (Tabela 1) foram encontradas 43 sem muco (36,75%), 33 com muco limpo (28,20%) e 25 com muco turvo (21,37%).
Tabela 1. Classificação das vacas com ou sem endometrite de acordo com a característica do muco vaginal.
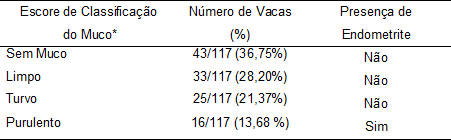
*Classificação de acordo com McDougall et al. (2007).
Os valores encontrados neste estudo estão de acordo com alguns autores como Le Blanc et al. (2002), que encontraram taxa de 16,9% para endometrite pós-parto em pesquisa realizada com 1865 vacas Holandesas com dias pós-parto entre 15 e 60. Uma proporção aproximada também foi encontrada por Gautam et. al. (2010), que identificaram a prevalência correspondente a 23,3% de endometrite em 441 vacas Holandesas estudadas 20 e 33 dias pós-parto. Potter et al. (2010) encontraram 27% de endometrite clínica trabalhando com 293 animais com 21 a 28 dias pós parto. Jesus et al. (2010) encontraram 18,57% de endometrite clínica trabalhando com 70 vacas leiteiras mestiças de 39 a 70 dias pós-parto.
As vacas avaliadas apresentaram DPP médio de 50 dias, variando entre 30 e 90 dias. A incidência de endometrite clínica foi de 17,95% nas vacas com DPP menor que 50 e de 5,13% nas vacas com DPP maior que 50 (P = 0,077), esse resultado sugere que existe cura espontânea da enfermidade a medida que aumenta os dias pós-parto.
Tabela 2: Efeito dos dias pós-parto, presença de corpo lúteo e escore de condição corporal na incidência de endometrite em vacas Holandesas, Uberlândia-MG, 2011.
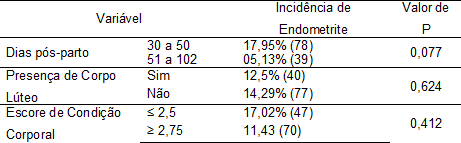
Gautam et al. (2010), investigaram se o período pós-parto influenciava a ocorrência de endometrite, realizaram um estudo com 441 vacas Holandesas e, para os autores, alguns animais no mesmo rebanho podem resolver infecções uterinas espontaneamente, assim, à medida que aumenta o DPP surgem mais vacas livres de endometrite. Por esse motivo, fêmeas com menor DPP têm maiores chances de apresentar a doença do que vacas com maior DPP, pois se espera que com o aumento do DPP elas resolvam espontaneamente a infecção. Jesus et al. (2010) trabalhando com vacas leiteiras mestiças, não encontraram efeito do DPP na incidência de endometrite clínica.
A presença de corpo lúteo e o escore de condição corporal não influenciaram (P > 0,05) a incidência de endometrite clínica (Tabela 2). Carneiro et al. (2010) trabalhando com 172 vacas leiteiras mestiças entre 32 e 70 dias pós-parto também não encontraram influência da presença ou ausência de CL na incidência de endometrite citológica (endometrite subclínica), porém, encontraram maior prevalência de endometrite citológica em vacas com escore de condição corporal menor ou igual a 2,5. Não foi detectada (P > 0,05) diferença na eficácia dos dois métodos de diagnóstico da endometrite clínica (técnica da mão enluvada vs. vaginoscopia de imagem; Tabela 3).
Tabela 3: Porcentagem de vacas que foram diagnosticadas com endometrite tanto pelo vaginoscópio de imagem quanto pela técnica da mão enluvada ou que foram diagnosticadas como positivas em apenas uma das técnicas.
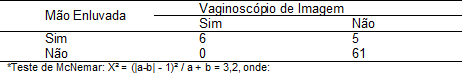
a = testes dados como positivos confirmados pelo método alternativo, mas que são negativos pelo método convencional.
b = testes dados como negativos pelo método alternativo, mas que são positivos confirmados pelo método convencional.
Valores do Qui-quadrado maiores ou iguais a 3,84 indicam que as proporções positivas confirmadas pelos métodos alternativos e de referência diferem significativamente para um nível de significância p menor ou igual a 0,05.
Pleicha et al. (2009) comparando três métodos de diagnóstico de endometrite clínica em 1002 animais da raça holandesa: vaginoscópio, dispositivo vaginal (Metricheck, Simcro, Nova Zelândia) e a técnica da mão enluvada, encontraram 40,6% de prevalência de endometrite. Um número maior de animais foram diagnosticados como positivos pelo dispositivo Metricheck quando comparado com a vaginoscopia e a mão enluvada (47.5 vs. 36,9 e 36,8%). Foi detectada concordância para diagnóstico de endometrite clínica entre a vaginoscopia e o método da mão enluvada.
Pela técnica da vaginoscopia de imagem detectou-se 8,3% (6/72) resultados positivos para endometrite clínica e pela técnica da mão enluvada 15,2% (11/72).
A utilização do vaginoscópio de imagem como ferramenta de diagnóstico se mostrou eficaz, porém sua aplicabilidade é baixa, pois é uma ferramenta sensível, de difícil manipulação, além do inconveniente de ter que ser higienizada a cada exame, o que dificulta sua utilização em um grande número de animais no mesmo dia. Já a avaliação da secreção cérvicovaginal, pela técnica da mão enluvada se mostrou bastante eficiente e prática para diagnosticar doenças uterinas, e pode ser realizada em um grande número de animais no mesmo dia sem causar atrasos na rotina de avaliação reprodutiva do rebanho.
Este texto é parte do trabalho de conclusão de curso apresentado à Faculdade de Medicina Veterinária da Universidade Federal de Uberlândia, pelo aluno Adolfo Firmo Ferreira.
REFERÊNCIAS
AHMADI, M. R., TAFTI, K. A., NAZIFI, S., & GHAISARI, H. R. The comparative evaluation of uterine mucosa cytology with endometrial histopathology in cows. Comp Clin Path , p. 90-94, 2005.
Barlund C. S.; Carruthers T. D.; Waldner C. L.; and Palmer C. W. A comparison of diagnostic techniques for postpartum endometritis in dairy cattle. Theriogenology v.69, p. 714-723, 2008.
Bello, N. M., Steibel J. P., Pursley J. R.. Optimizing ovulation to first GnRH improved outcomes to each hormonal injection of Ovsynch in lactating dairy cows. Journal of Dairy Science, v.89, p.3413-3424, 2006.
BENMRAD, M.F.; STEVENSON, S.J. Gonadotropin-realising hormone and prostaglandin F2α for postpartum dairy cows: estrous, ovulation, and fertility traits. Journal of Dairy Science, v. 69, p. 800-811, 1986.
BONDURANT, R. Inflammaton in the bovine female reproductive tract. Journal of Animal Science , v. 77, p. 101-110, 1999.
BRITT, J. H. Enhanced reproduction and its economic implications. Journal of Dairy Science, v. 68, p. 1585-1592, 1985.
CARNEIRO, L. C. Endometrite citológica em vacas leiteiras mestiças e vacas de corte nelore: Incidência e relação com o desempenho reprodutivo. 2011. 79f. Tese (Mestrado em Ciências Veterinárias)- Faculdade de Medicina Veterinária, Universidade Federal de Uberlândia, Uberlândia, 2011.
DOHMEN et al. Relationship between intra-uterine bacterial contamination, endotoxin levels and the development of endometritis in postpartum cows with distocia or retained placenta.Theriogenology, Stoneham, v. 54, p. 1019-1032, 2000.
FÖLDI et al. Bacterial complications of postpartum uterine involution in cattle. Animal Reproduction Science , v. 96, p. 265-281, 2006.
FOOTE, R. H. Estrus detection and estrus detectionaids. Journal of Dairy Science, v. 58, p. 248-256, 1975.
GAINES, J.D. Proceedings for annual meeting. Kansas City : Society for Theriogenology, 1994. Analysis of reproductive efficiency of dairy herds: p.86-107.
GAUTAM et al.Prevalence of endometritis during the postpartum period and its impact on subsequent reproductive performance in two japanese dairy herds. Animal Reproduction Science, v.116, p. 175-187, 2008.
GAUTAM et al. Spontaneous Recovery or Persistence of Postpartum Endometritis and Risk Factors for its Persistence in Holstein Cows. Theriogenolgy., v. 73, p. 168-179, 2010.
GILBERT et al. Prevalence of endometritis and its effects on reproductive performance of dairy cows. Theriogenology, v. 64, p. 1879-1888, 2005.
GRÖHN, Y.T.; RAJALA-SCHULTZ, P.J. Epidemiology of reproductive performance in dairy cows. Animal Reproduction Science, v. 60-61, p. 605-614, 2000.
JESUS, D. C. Incidência de endometrite clínica em vacas de leite mestiças no final do período voluntário de espera. 2010. 28f. Monografia (Graduação em Medicina Veterinária)- Faculdade de Medicina Veterinária, Universidade Federal de Uberlândia, Uberlândia, 2010.
KANEKO, K.; KAWAKAMI, S. The roles of PFG2α and PGE2 in regression of the corpus luteum after intrauterine infusion of Arcanobacterium pyogenes in cows. Theriogenology, v.71, p.858-863, 2009.
KIM, I. H., YANG, M. P. & NA, K. J. Immune responses during the peripartum period un dairy cows with postpartum endometritis. Journal of Reproduction and Development , v. 51, p. 757-764, 2005.
LE BLANC et al. Defining and Diagnosing postpartum clinical endometritis and its impact on reproductive performance in dairy cows. Journal of Dairy Science , v. 85, p. 2223-2236, 2002.
LEWIS, G. S.Uterine health and disorders. Journal of Dairy Science , v. 80, p. 984-994, 1997.
McDOUGALL, S. R. Gross abnormalities, bacteriology and histological lesions of uteri of dairy cows failing to conceive or maintain pregnancy. New Zealand Veterinary Journal, v. 53, p. 253-256, 2005.
McDOUGALL, S.R.; MACAULY, R.; COMPTON, C. Association between endometritis diagnoses using a novel intravaginal device and reproductive performance in dairy cattle. Animal Reproduction Science, v.99, p.9-23, 2007.
NOAKES et al. Arthur´s veterinary reproduction and obstetrics, 8th ed., Elsiever Science, Ltd, London, 2002.
OLSON et al. Aspects of bacteriology and endocrinology of cows with pyometra and retained fetal membranes. American Journal of Veterinary Research, v. 45, p. 2251-2255, 1984.
PLETICHA, S.; DRILLICH, M.; HEUWEISER, W. Evaluation of the metricheck device and the gloved hand for the diagnosis of clinical endometritis in dairy cows. Journal of Dairy Science, v.92, p. 5429-5435, 2009.
POTTER T.J.; GUITIAN J.; FISHWICK J. Risk factors for clinical endometritis in postpartum dairy cattle. Theriogenology, v. 74, p. 127-134, 2010.
RUDER et al. Uterine infections in the postpartum cow: II Possible synergistic effect of Fusobacterium necrophorum and Corynebacterium pyogenes. Theriogenology, v.15, p.573-580, 1981.
SANTOS, R. M., VASCONCELOS, J. L. M., SOUZA, A. H., MENEGHETTI, M., FERREIRA, N. Efeito da aplicação de prostaglandina (PGF2a ) no pós-parto imediato sobre a incidência de retenção de placenta em vacas de leite. Arquivo Brasileiro de Medicina Veterinária e Zootecnia., Belo Horizonte, v. 54, p. 29-34, fev. 2002.
SEEGERS, H. Economics of the reproductive performance of dairy herds. In XXIV World Buiatrics Congress, Nice, France, 2006.
SHELDON et al. Effect of postpartum manual examination of the vagina on bacterial contamination in cows. The Veterinary Record , p. 531-534, 2002.
SHELDON, I. M. Endometritis in cattle: pathogenesis, consequences for fertility, diagnosis and therapeutic recommendations. Partners Reprod, v.2, p.1-5, 2007.
SHELDON, I.M. The postpartum uterus. Veterinary clinics: Food Animal Practice, Londres, v.20, p.569-591, 2004.
SHELDON, I. M.; DOBSON, H. Postpartum uterine health in cattle. Animal Reproduction Science, v.82-83, p.295-306, 2004.
SHELDON, I., LEWIS, G., LEBLANC, S., GILBERT, R. Defining postpartum uterine disease in cattle. Theriogenology , v. 65, p. 1516-1530, 2006.
SHELDON et al. Mechanisms of infertility associated with clinical and subclinical endometritis in high producing dairy cattle. Reprod Domest Anim, v.44, p.1-9, 2009.
SHELDON et al Uterine diseases in cattle after parturition. The Veterinary Journal , v.176, p. 115-121, 2008.
STEVENSON, J. S., CALL, E. P. Reproductive disorders in the periparturient dairy cow. Journal of Dairy Science, v. 71, p. 2572-2583, 1988.
STUDER, E.; MORROW, D. A. Postpartum evaluation of bovine reproductive potential: comparison of findings from genital tract examination per rectum, uterine culture, and endometrial biopsy. Journal of the American Veterinary Medical Association. v.172, p. 489-494, 1978.
VASCOLCELOS et al. Detecção de subfertilidade em vacas leiteiras por meio de medidas anatômicas da região pélvica e do aparelho genital. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. V.52, n.5, p.468-474, 2000.
VASCONCELOS, J.L.M., SILVA, H.M., REIS, R.B. et al. Involução do sistema genital pós-parto de vacas Holandesas cruzadas e puras por cruza. Arquivo Brasileiro de Medicina Veterinária e Zootecnia., v.45, p.405-418, 1993.
WASHBURN et al. Trends in reproductive performance in southeastern Holstein and Jersey DHI herds. Journal of Dairy Science, v. 85, n. 1, p. 244-251, 2002.
WILLIAMS et al. Clinical evaluation of postpartum vaginal mucus reflects uterine bacterial infection and the inflammatory response to endometritis in cattle. Theriogenology, v.63, p.102-17, 2005.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS













