As caseínas são proteínas extremamente importantes do ponto de vista tecnológico e nutricional, encontradas em grandes quantidades no leite de ruminantes. No leite bovino, há cerca de 3,2% (m/m) de proteínas, sendo que 80% delas são caseínas e 20% são proteínas do soro.
Em relação às caseínas, elas são divididas em quatro tipos (αs1-, αs2-, β- e κ-caseína), que majoritariamente agregam-se no leite, formando as chamadas micelas de caseína (MC). As MC além de conterem as proteínas ainda contêm sais minerais (dos quais 95% é fosfato de cálcio coloidal, FCC) e água (FOX e McSWEENEY, 2003).
Desta forma, fica evidente que o papel nutricional das caseínas vai além de carrear proteínas de alto valor biológico, pois as MC também tornam o leite uma excelente fonte de sais minerais, em especial, de cálcio.
Os dois grupos proteicos (caseínas e proteínas do soro) do leite diferem-se consideravelmente em relação às características nutricionais, mas também no que diz respeito às suas propriedades físico-químicas. Neste artigo iremos abordar os aspectos relacionados à estabilidade térmica das caseínas.
As moléculas de caseína desnaturam?
A estrutura primária das caseínas (de proteínas, de modo geral) corresponde à sequência de resíduos de aminoácidos unidos entre si por meio de ligações peptídicas formando uma cadeia linear. Após a formação das estruturas primárias, as caseínas sofrem modificações pós-traducionais, chamadas de fosforilação (em que grupos fosfatos são inseridos nos resíduos de serina principalmente das αs1-, αs2- e β- caseínas) e de glicosilação (quando grupos de carboidratos são ligados à κ-caseína).
As proteínas podem apresentar um arranjo espacial, na forma de folhas β e α-hélices, formado a partir de interações entre aminoácidos que estão próximos na estrutura primária, configurando a chamada estrutura secundária.
No entanto, a presença de muitos resíduos de prolina distribuídos uniformemente ao longo da estrutura primária das caseínas dificulta a formação dessas estruturas secundárias. Como a estrutura terciária trata-se do arranjo tridimensional da proteína a partir da formação de interações entre aminoácidos mais distantes dentro da estrutura primária, podemos concluir que as caseínas também não possuem esse tipo de organização bem definida em razão do alto conteúdo de prolina em suas cadeias polipeptídicas.
O processo de desnaturação proteica é definido como a perda das estruturas secundária e terciária das proteínas mediante exposição a agentes desnaturantes, como agentes químicos, acidez ou mudanças das condições do meio (temperatura e pressão).
Portanto, como as caseínas são proteínas desordenadas, elas são consideradas “parcialmente desnaturadas” (THORN et al., 2015), o que significa que elas são mais resistentes termicamente quando comparadas às proteínas do soro.
Como o aumento da temperatura afeta a estrutura das micelas de caseína?
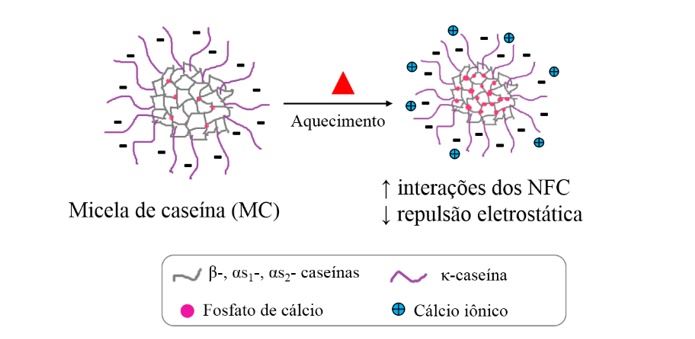
Na estrutura das MC, as moléculas de caseínas interagem entre si por meio de ligações de hidrogênio e interações hidrofóbicas, eletrostáticas e de van der Waals formando um aglomerado de proteínas. Além disso, o FCC forma nanoagregados (cerca de 2 nm), chamados de nanoclusters de fosfato de cálcio (NFC), onde formam-se pontos de ligação entre as regiões fosforiladas das frações de caseínas (β-, αs1-, αs2- caseínas).
As caseínas mais hidrofóbicas, β-, αs1-, αs2- caseínas, concentram-se mais no interior da nanoestrutura, enquanto a κ-caseína, que é a fração mais hidrofílica (devido à glicosilação), encontra-se na interface micela de caseína/fase contínua do leite.
As MC possuem ponto isoelétrico (pI) em pH igual a 4,6, portanto, elas estão negativamente carregadas no pH do leite (pH= 6,6). Assim, a estabilidade das MC em suspensão deve-se ao balanço das interações intermoleculares repulsivas e atrativas que ocorrem entre as MC (McMAHON e OOMMEN, 2013).
O leite é saturado em relação ao fosfato de cálcio, o que significa que a concentração deste sal presente no leite está acima da sua solubilidade. Isso só é possível, porque grande parte do fosfato de cálcio, isto é, a fração que excede a sua solubilidade, encontra-se na forma de NFC nas MC.
Sabe-se que a solubilidade dos sais, de maneira geral, é influenciada pela temperatura, sendo que, o aumento da temperatura causa uma diminuição da solubilidade do fosfato de cálcio e do cálcio iônico (Ca2+) influenciando na estabilidade térmica do leite. No leite, o fosfato de cálcio e o Ca2+ estão em equilíbrio da seguinte forma: fase contínua (fase aquosa) ⇔ fase coloidal (MC).
Assim, qualquer alteração no leite que leve à redução da solubilidade destes constituintes, fará com que o equilíbrio se desloque no sentido da fase coloidal, com isso, fosfato de cálcio e Ca2+ em solução na fase contínua do leite se difundem para a fase coloidal, isto é, para as MC.
Essa difusão pode neutralizar as cargas negativas da interface das MC diminuindo a repulsão eletrostática entre elas (por meio da adsorção de Ca2+ na interface da MC) e/ou intensificar as interações entre as caseínas dentro da MC (mediadas pelos NFC).
Além das interações mediadas pelos NFC, as interações hidrofóbicas também são intensificadas com o aumento da temperatura e, o fortalecimento dessas interações pode levar à redução do diâmetro das MC (Figura 1). Nesse sentido, esses fatores, dependendo da extensão, podem causar a desestabilização das MC, porque modificam o balanço de forças que existe para manter a estrutura micelar estável.
Figura 1. Representação esquemática do efeito do tratamento térmico na estrutura da micela de caseína.
Diferente das caseínas, as proteínas do soro possuem estruturas terciárias e podem desnaturar mediante exposição a altas temperaturas (maiores que 60 °C). A desnaturação dessas proteínas, sobretudo da β-lactoglobulina (β-lg), causa impactos nas MC.
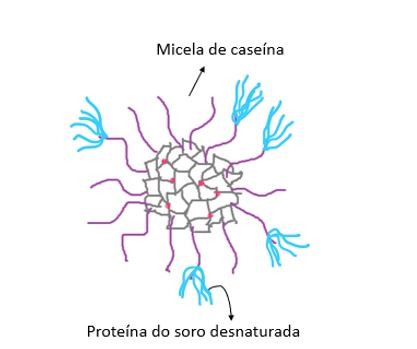
A β-lg desnaturada tem seus grupamentos sulfridrílicos expostos e portanto, disponíveis para formar ligações dissulfeto (S-S) entre a β-lg desnaturada e a κ-caseína (presente na interface das MC). Esse complexo é chamado de β-lactoglobulina- κ-caseína (βlg-κcas) e contribui muito para o aumento de viscosidade do leite, uma vez que são partículas coloidais grandes que interagem fortemente com a água (WALSTRA, et al. 2006).
Portanto, apesar das caseínas não desnaturarem, o aumento da temperatura pode provocar alterações nas suas estruturas e, consequentemente, afetar a estabilidade dessas proteínas.
Quais são as consequências tecnológicas do aquecimento sobre as caseínas?
As alterações estruturais das MC causadas pelo aquecimento resultam em uma série de implicações tecnológicas no processamento de leite e derivados. Por exemplo, o tratamento UHT envolve o aquecimento do leite a temperaturas de 135-150 °C por alguns segundos, seguido de acondicionado asséptico, sendo um produto lácteo de alto consumo no Brasil em razão da sua elevada vida de prateleira (entre 9–12 meses), sem necessitar de refrigeração (AKKERMAN et al., 2021).
Durante o aquecimento, a diminuição da solubilidade do Ca2+ causa uma ligeira acidificação do leite em função do seguinte equilíbrio:
Desde modo, a liberação de H+, quando o fosfato de cálcio precipita, torna o leite tratado termicamente mais ácido comparado ao leite cru. Esta acidez pode levar à desestabilização das caseínas e consequente precipitação do leite nos trocadores de calor utilizados no processamento UHT.
Para evitar esta precipitação é comum a adição de sais complexantes do Ca2+ no processamento de leite UHT. Esses complexantes, como os polifosfatos e citratos, tem como principal função formar complexos solúveis com Ca2+, evitando que durante o aquecimento haja a redução do pH do leite.
Na produção de iogurte o leite é aquecido a 95 °C durante 5 minutos, o que leva à intensa produção complexos βlg-κcas (Figura 2). Nesse caso, há um aumento considerável da viscosidade. Além disso, há uma completa alteração do comportamento reológico do leite durante a sua conversão em iogurte em função da acidificação do meio decorrente da ação das bactérias fermentadoras.
Figura 2. Representação dos agregados formados entre as micelas de caseína e as proteínas do soro desnaturadas.
Apesar de a formação dos complexos βlg-κcas exercerem um efeito positivo sobre a viscosidade do leite, especialmente em relação a alguns derivados do leite, como iogurte, leite condensado e doce de leite, o mesmo não é verificado quando se trata da obtenção de queijos via coagulação enzimática. Este tipo de coagulação envolve duas etapas: primeiramente, a ação da enzima (quimosina) e, em seguida, a agregação das caseínas (αs1-, αs2-, β- caseínas e para- κ -caseína com o Ca2+.
A formação dos complexos βlg-κcas atua na segunda etapa da coagulação resultando no aumento do tempo desse processo em leite tratado termicamente (ANEMA et al., 2007). Além disso, o aquecimento do leite, como a pasteurização, também reduz a solubilidade do Ca2+, que é essencial para a coagulação.
Desta forma, a adição de CaCl2 é uma prática comum na fabricação de queijos, visto que repõe o Ca2+ insolubilizado, além de reduzir a repulsão eletrostática entre proteínas necessárias para formar o coágulo que formará o queijo.
As caseínas são proteínas de grande relevância para indústria de laticínios, sendo que apesar de serem estruturas naturalmente desordenadas (desnaturadas), os nanocompósitos orgânico-inorgânicos formados por elas juntamente com sais e água sofrem alterações provocadas pela temperatura. Estas alterações são em menor grau de ordem conformacional e em maior extensão de natureza eletrostática e hidrofóbica.
Gostou do conteúdo? Deixe seu like e seu comentário, isso nos ajuda a saber que conteúdos são mais interessantes para você. Quer escrever para nós? Clique aqui e veja como!
Referências
AKKERMAN, M. E.; JOHANSEN, L. B.; RAUH, V.; SØRENSEN, J.; LARSEN, L. B.; POULSEN, N. A. Relationship between casein micelle size, protein composition and stability of UHT milk. International Dairy Journal. vol.112, 2021, 104856.
ANEMA, S. G.; LEE, S. K.; KLOSTERMEYER, H. Effect of pH at heat treatment on the hydrolysis of k-casein and the gelation of skim milk by chymosin. LWT - Food Science and Technology, vol. 40, 2007, 99-106.
FOX P.F., MCSWEENEY P.L.H., Advanced dairy chemistry - Proteins, vol. 1, 3ª edição, Kluwer Academic/Plenum Publishers, New York, 2003, 1356p.
McMAHON, D. J., OOMMEN, B. S.. Casein Micelle Structure, Functions, and Interactions. In Advanced Dairy Chemistry, 4ª edição. Boston, MA: Springer US, 2013, pp. 185–209.
THORN, D.C., ECROYD, H., CARVEC., J.A., HOLT, C. Casein structures in the context of unfolded proteins. International Dairy Journal, vol. 46, 2015, 2-11.
WALSTRA, P., WOUTERS, J. T. M., GEURTS, T. J., Dairy Science and Technology, 2ª edição. Boca Raton: CRC Press, Taylor & Francis Group, 2006, 783p.
*Fonte da foto do artigo: Freepik

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS