Os carotenoides são pigmentos naturais lipofílicos, consistindo de uma cadeia linear com 40 carbonos, sendo oito unidades de isopreno C5 e múltiplas ligações duplas conjugadas (ALWIS; CHANDRIKA; JAYAWEERA, 2015; CHEN et al., 2014).
São divididos em duas classes: carotenos, que são carotenoides hidrocarbonetos (ex. β-caroteno e isorenierateno), e xantofilas, que são carotenoides oxigenados (ex. astaxantinha e luteína), sendo compostos reconhecidamente valorizados devido às suas atividades bioativas benéficas à saúde (CHEN et al., 2014).
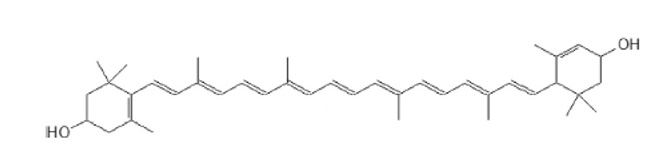
A luteína (β,ε-caroteno-3,3'-diol) (Figura 1) é um corante natural amarelo-laranja geralmente encontrado em vários vegetais folhosos (espinafre e couve), frutas (caqui, manga e melancia) e gema de ovo (KIJLSTRA et al., 2012; TAN et al., 2016).
Figura 1. Estrutura química da luteína.
Por apresentar potenciais propriedades bioativas, a luteína é reconhecida como um corante alimentar atrativo para substituir corantes artificiais e desenvolvimento de alimentos funcionais (SOBRAL et al., 2016).
A luteína comercial é geralmente obtida a partir da sua extração de flores de calêndula (Tagetes erecta). Embora seja sintetizada exclusivamente em plantas, também está presente em animais, sendo essencial sua ingestão através da dieta diária (KHALIL et al., 2012; MADAAN et al., 2017).
Juntamente com a zeaxantina, a luteína encontra-se altamente concentrada na mácula da retina no olho, onde sua função é proteger a retina ao absorver a luz azul incidente. Além disso, pode atuar como agente antioxidante por eliminação de radicais livres ou oxigênio singlete, diminuindo assim o estresse oxidativo na retina (DALLAS; TRABER, 2018; NAGAO, 2014).
Diversos estudos têm relatado atividades biológicas e farmacológicas da luteína, tais como: anti-inflamatória e antioxidante, anticâncer, estímulo ao sistema imune, redução do risco de doenças relacionadas aos olhos, como degeneração macular, catarata e redução do risco de doenças cardiovasculares.
Segundo Lieblein-Boff et al. (2015), nos cérebros de crianças a luteína representa mais de metade da concentração de carotenoides totais, sugerindo a necessidade de luteína durante o desenvolvimento neural.
Entretanto, a biodisponibilidade da luteína é pequena (cerca de 10-15%) e muito variável devido à sua baixa solubilidade em água (34,2 mg L-1), sendo totalmente dependente da natureza do solvente ou molécula transportadora (MADAAN et al., 2017).
Consequentemente, a aplicação de luteína na tecnologia de alimentos e nutracêuticos é limitada devido à sua baixa solubilidade aquosa e instabilidade em diferentes condições de processamento em termos de pH, temperatura, força iônica, luz e oxigênio (DIMA et al., 2018; YI et al., 2016). Diante deste contexto, esforços vêm sendo dedicados pela comunidade científica de modo a otimizar e ampliar a aplicação deste corante bioativo em diversos alimentos e fármacos.
Logo, este artigo tem o objetivo de apresentar o potencial das proteínas lácteas como agentes carreadores de luteína assim como as aplicações deste carotenoide, fundamental para a saúde humana, como corante em produtos lácteos.
Proteínas do leite como biopolímeros carreadores de luteína
As proteínas têm um papel importante no transporte e proteção de componentes bioativos em alimentos funcionais devido à sua capacidade de formar complexos, possivelmente protegendo os componentes ligados contra fotodegradação e oxidação (ELZOGHBY; SAMY; ELGINDY, 2012).
Estudos recentes demonstraram a formação de complexos entre proteínas lácteas e luteína. Yi et al. (2016) mostraram que as interações de luteína com isolado proteico de soro (WPI) e com caseinato de sódio (CS), em pH 7,4 e 25 °C, indicaram que a formação de complexos entre luteína e WPI ou CS aumentou a estabilidade do carotenoide.
Mora-Gutierrez et al. (2018) investigaram as interações de caseínas bovina (CNbovina) e caprina (CNcaprina) com luteína em pH 7,0 usando espectroscopia de fluorescência e UV-vis e confirmaram que a solubilidade aquosa da luteína aumentou devido à formação de complexos caseína/luteína. Paiva et al. (2020) demonstraram, por meio da técnica de espectroscopia de fluorescência, a formação de um complexo estável entre luteína e albumina do soro bovino (BSA) tanto no seu estado nativo quando após sofrer desnaturação térmica, em pH 7,4. Rezende et al. (2020) demonstraram a formação de nanocomplexos entre luteína e lisozima como um método alternativo para transporte da luteína e melhoria de sua estabilidade química.
Aplicações de luteína como corante bioativo em derivados lácteos
Diante das potencialidades da luteína como corante bioativo em alimentos, pesquisas vêm sendo desenvolvidas com o intuito de otimizar a sua aplicação na indústria de laticínios.
Sobral et al. (2016) avaliaram a substituição do urucum, tradicionalmente utilizado como corante na fabricação de queijo Prato, por luteína. Os queijos Prato adicionados de luteína tiveram aceitação sensorial semelhante aos queijos com urucum, e os índices de proteólise (extensão e profundidade), pH e perfil de textura dos queijos não foram afetados durante a maturação, apesar da substituição do corante. Logo, o queijo Prato foi considerado uma matriz carreadora de luteína, pois a atividade antioxidante do corante também foi mantida ao longo da maturação.
"Refrigerante do bem"
Em 2016, A Empresa de Pesquisa e Agropecuária de Minas Gerais/Instituto de Laticínios Cândido Tostes (EPAMIG / ILCT) desenvolveu, com o apoio financeiro da Fundação de Amparo à Pesquisa de Minas Gerais (FAPEMIG) e sob a Coordenação do prof. Dr. Junio César Jacinto de Paula, uma bebida láctea sabor laranja, acidificada, carbonatada e enriquecida com luteína, denominada “refrigerante do bem” (Figura 2).
Além do sabor e rica composição, já que a bebida foi produzida à base de leite e soro de leite, outro diferencial foi o seu prazo de validade estendido até 90 dias sob temperatura ambiente, sem alterar a sua densidade nutricional.
Figura 2. Bebida láctea sabor laranja, acidificada, carbonatada e enriquecida com luteína (“refrigerante do bem”), desenvolvida pela EPAMIG / ILCT.
Foto: Junio César Jacinto de Paula.
Aproveitando-se do potencial da luteína, novas pesquisas têm sido iniciadas pela EPAMIG ILCT como a sua aplicação na fabricação de manteiga, leite aromatizado e requeijão, porém objetivando a manutenção das propriedades bioativas e biodisponibilidade do corante durante o armazenamento dos produtos e consumo.
Considerações finais
Além de ser um pigmento natural empregado nos mais diversos tipos de alimentos como óleos comestíveis, margarina, maionese e mostarda, dentre outros, também pode ser utilizado na indústria de alimentos funcionais no enriquecimento de produtos de frutas, cereais e derivados lácteos.
Através de estudos toxicológicos e epidemiológicos, ficou comprovado que a luteína é um produto seguro, sendo considerada uma substância GRAS (Generally Recognized as Safe). A utilização da luteína pode ser feita sem que haja alteração sensorial no produto, além da coloração que tenderá para um tom mais alaranjado (DAGNELIE, 2000).
Conclusão
A luteína, apesar de ser um corante lipofílico, pode ser carreada por várias proteínas do leite e, possivelmente, diferentes produtos lácteos, conforme demonstrado em estudos desenvolvidos nos últimos anos.
Como a luteína não é sintetizada pelo organismo humano, recomenda-se a sua ingestão de 6 a 20 mg/dia, quantidade associada com a redução da incidência de degeneração macular. Neste contexto, a aplicação de luteína na indústria de laticínios surge como uma oportunidade de otimizar a ingestão diária desta molécula bioativa imprescindível à saúde humana, principalmente na prevenção de doenças oculares relativas à idade.
Entretanto, deve-se intensificar as pesquisas relacionadas aos fatores que podem alterar a capacidade de carreamento da luteína por matrizes alimentares lácteas, tais como a presença de diferentes sais (p. ex., os sais cosmotrópicos e caotrópicos da série Hofmeister), variações de pH e de força iônica, além de mudanças conformacionais nas proteínas lácteas devido à tecnologia aplicada (tratamento térmico ou uso de tecnologias não convencionais como o ultrassom). Além disso, devem ser realizados estudos in vivo para melhor compreensão da biodisponibilidade e absorção da luteína pelo organismo, quando esta estiver presente nas diversas matrizes lácteas.
No próximo artigo iremos abordar sobre o "refrigerante do bem", potencial aplicação da luteína na indústria de laticínios. Fiquem ligados!
Referências
ALWIS, D. D. D. H.; CHANDRIKA, U. G.; JAYAWEERA, P. M. Spectroscopic studies of neutral and chemically oxidized species of β-carotene, lycopene and norbixin in CH2Cl2: Fluorescence from intermediate compounds. Journal of Luminescence, v. 158, p. 60–64, 2015.
CHEN, L. et al. Encapsulation of β-carotene within ferritin nanocages greatly increases its water-solubility and thermal stability. Food Chemistry, v. 149, p. 307–312, 2014.
DAGNELIE, G. ZORGE, 1., McDONALD, T. M. Lutein improves visual function in some patients whit retinal degeneration: a pilot study via the internet. Optometry. V. 71, p. 147-164, 200.
DALLAS, D. C.; TRABER, M. G. How does breast milk enhance lutein absorption? Journal of Nutrition, v. 148, n. 1, p. 1–2, 2018.
DIMA, I. G. et al. Binding mechanisms between lycopene extracted from tomato peels and bovine β-lactoglobulin. Journal of Luminescence, v. 203, n. July, p. 582–589, 2018.
ELZOGHBY, A. O.; SAMY, W. M.; ELGINDY, N. A. Protein-based nanocarriers as promising drug and gene delivery systems. Journal of Controlled Release, v. 161, n. 1, p. 38–49, 2012.
KHALIL, M. et al. Stability and bioavailability of lutein ester supplements from Tagetes flower prepared under food processing conditions. Journal of Functional Foods, v. 4, n. 3, p. 602–610, 2012.
KIJLSTRA, A. et al. Lutein: More than just a filter for blue light. Progress in Retinal and Eye Research, v. 31, n. 4, p. 303–315, 2012.
LIEBLEIN-BOFF, J. C.; JOHNSON, E. J.; KENNEDY, A. D.; LAI, C. S.; KUCHAN, M. J. Exploratory Metabolomic Analyses Reveal Compounds Correlated with Lutein Concentration in Frontal Cortex, Hippocampus, and Occipital Cortex of Human Infant Brain. PLOS ONE, v. 10, p. 1-19, ago. 2015.
MADAAN, T. et al. Lutein, a versatile phyto-nutraceutical: An insight on pharmacology, therapeutic indications, challenges and recent advances in drug delivery. PharmaNutrition, v. 5, n. 2, p. 64–75, 2017.
MORA-GUTIERREZ, A. et al. Complexes of lutein with bovine and caprine caseins and their impact on lutein chemical stability in emulsion systems: Effect of arabinogalactan. Journal of Dairy Science, v. 101, n. 1, p. 18–27, 2018.
NAGAO, A. Bioavailability of dietary carotenoids: Intestinal absorption and metabolism. Japan Agricultural Research Quarterly, v. 48, n. 4, p. 385–392, 2014.
REZENDE, J. P. et al. Temperature modulation of lutein-lysozyme hydrophobic-hydrophilic interaction balance. Journal of Molecular Liquids, v. 316, p. 113887, 2020.
REZENDE, J. P. et al. Temperature modulation of lutein-lysozyme hydrophobic-hydrophilic interaction balance. Journal of Molecular Liquids, v. 316, p. 113887, 2020.
SOBRAL, D. et al. Can lutein replace annatto in the manufacture of Prato cheese? LWT - Food Science and Technology, v. 68, p. 349–355, 2016.
TAN, T. B. et al. Forming a lutein nanodispersion via solvent displacement method: The effects of processing parameters and emulsifiers with different stabilizing mechanisms. Food Chemistry, v. 194, p. 416–423, 2016.
YI, J. et al. Characterization of milk proteins-lutein complexes and the impact on lutein chemical stability. Food Chemistry, v. 200, p. 91–97, 2016.
*Fonte da foto do artigo: Freepik

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS