O leite de vaca apresenta em média 3,23% (m/m) de proteínas, sendo 2,6% (m/m) caseínas (αs1-, αs2-, β- e κ-caseína) e 0,63% (m/m) proteínas do soro (β-lactoglobulina, α-lactoalbumina, albumina do soro bovino (BSA), imunoglobulinas e glicomacropeptídeo (GMP), além de pequenas concentrações de lactoferrina, lisozima e lactoperoxidase) (WALSTRA; WOUTERS; GEURTS, 2006). Ou seja, as proteínas do soro representam aproximadamente 20% do total de proteínas do leite.
As proteínas do soro são solúveis em ampla faixa de pH, apresentam estrutura globular com hidrofobicidade relativamente alta e são ricas em aminoácidos contendo sulfeto, como cisteína e metionina. Além disso, possuem pontes dissulfeto que conferem um determinado grau de estabilidade estrutural.
Ao contrário das caseínas, as proteínas do soro não precipitam em seus pontos isoelétricos, porém desnaturam quando submetidas ao aquecimento (WALSTRA; WOUTERS; GEURTS, 2006; METSÄMUURONEN; NYSTRÖM, 2009). A Tabela 1 apresenta a composição média das proteínas do soro de leite de vaca.
Tabela 1. Composição média das proteínas do soro de leite de vaca.
Fonte: adaptado de Marchall, 2004.
Além de amplamente aplicadas na indústria de alimentos devido às suas propriedades funcionais (p. ex. solubilidade, emulsificação e formação de gel e espuma) e nutricionais, as proteínas do soro de leite, como a BSA, são biopolímeros naturais utilizados para veicular moléculas bioativas e protegê-las contra a oxidação e a degradação (MCCLEMENTS; DECKER, 2000).
A BSA tem sido amplamente estudada devido à sua capacidade de transporte e proteção de uma variedade de substâncias benéficas à saúde, como a luteína (PAIVA et al., 2020), o β-caroteno (SILVA et al., 2018) e a curcumina (HUDSON et al., 2018). Logo, a BSA apresenta-se como uma molécula promissora para aplicação na tecnologia de alimentos nutracêuticos e de fármacos.
Este artigo tem o objetivo de descrever a BSA, demonstrando seu potencial para carreamento e proteção de moléculas bioativas nas indústrias de alimentos e farmacêutica.
Albumina do soro bovino (BSA)
A BSA é a principal proteína solúvel no plasma sanguíneo de bovinos e desempenha um importante papel fisiológico, principalmente no transporte de uma variedade de substâncias endógenas e exógenas, incluindo ácidos graxos, aminoácidos, metais e fármacos no organismo (PAN et al., 2010; SHAHABADI; MAGHSUDI; ROUHANI, 2012). No leite, sua concentração é, em média, 0,4 g L-1 (WALSTRA; WOUTERS; GEURTS, 2006).
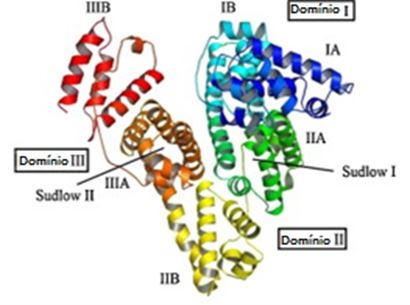
A BSA consiste em uma cadeia única de 582 aminoácidos, sendo uma proteína globular com 17 resíduos de cisteína (oito ligações dissulfeto e um grupo tiol livre). É dividida em três domínios linearmente dispostos (I, II e III), com cada domínio composto de dois subdomínios (A e B) (SHAHABADI; HADIDI, 2014). Além disso, possui dois resíduos de triptofano (Trp): o Trp134 localizado na superfície do domínio I (subdomínio IB) e o Trp213 localizado dentro da cavidade hidrofóbica do domínio II (subdomínio IIA). A Figura 1 apresenta uma representação estrutural da molécula de BSA.
Figura 1. Representação estrutural da molécula de BSA com seus domínios e subdomínios. A estrutura secundária da proteína é mostrada como uma molécula com os subdomínios com código de cores da seguinte forma: IA, azul; IB, azul celeste; IIA, verde; IIB, amarelo; IIIA, laranja; IIIB, vermelho.
Fonte: adaptado de Khodarahmi et al. (2012).
Diferentemente da BSA, a albumina do soro humano (HSA) é composta por 585 aminoácidos, possuindo apenas um resíduo de triptofano (Trp214) (CHENG, 2012). Apesar da similaridade entre HSA e BSA (76% das sequências de aminoácidos são idênticas), as duas proteínas apresentam propriedades de ligação diferentes (BOU-ABDALLAH et al., 2016; DAWOUD BANI-YASEEN, 2011).
Frequentemente, a BSA é escolhida como proteína modelo em estudos de interação com moléculas bioativas (RAHMAN; AFRIN; TABISH, 2018) devido à sua importância médica, abundância, facilidade de purificação, solubilidade em meio aquoso e estabilidade físico-química (SHAHABADI; HADIDI, 2014).
Devido à presença de resíduos de Trp em sua estrutura química, a BSA emite fluorescência quando excitada a 295 nm (Jahanban-Esfahlan; Panahi-Azar; Sajedi, 2016). Entretanto, quando a BSA interage com pequenas moléculas em regiões próximas aos resíduos de Trp (fluoróforos), a sua fluorescência intrínseca diminui com o aumento da concentração do ligante.
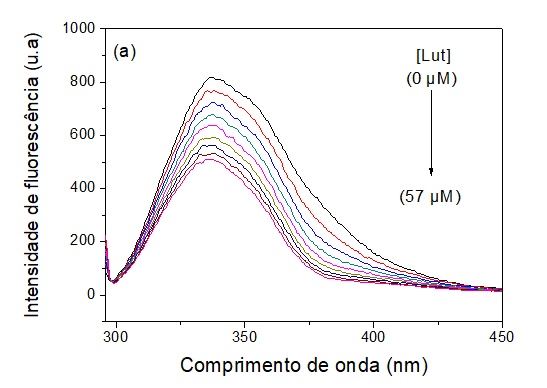
Assim, a técnica de espectroscopia de fluorescência pode ser utilizada para estudar o processo de interação entre a BSA e diversas moléculas de interesse. A Figura 2 mostra os espectros de fluorescência da BSA na presença de concentrações crescentes de luteína(1) em pH 7,4 e 30 °C.
Figura 2. Espectros de emissão de fluorescência da BSA (5 µM) na presença de concentrações crescentes de luteína em pH 7,4 (30 °C). A seta indica um aumento na concentração de luteína ([Lut]) de 0 a 57 μM (0, 8, 16, 23, 30, 37, 44, 50 e 57 μM).
Fonte: Paiva et al. (2020).
Diversos compostos bioativos, como os carotenoides (luteína, astaxantina, β-caroteno, dentre outros), tem seu uso limitado na tecnologia de alimentos e fármacos devido à sua baixa solubilidade em água e instabilidade em diferentes condições de processamento em função do pH, temperatura, força iônica, luz e oxigênio (DIMA et al., 2018).
Neste contexto, proteínas carreadoras como a BSA têm um papel fundamental no transporte e proteção destes componentes bioativos em alimentos funcionais devido à sua capacidade de formar complexos proteína-ligante, possivelmente protegendo os componentes ligados contra oxidação e degradação (ELZOGHBY; SAMY; ELGINDY, 2012).
Por exemplo, Silva et al. (2018) mostrou que a formação de complexo entre a BSA e β-caroteno aumentou a estabilidade deste carotenoide à luz. O β-caroteno é amplamente utilizado como corante na indústria de alimentos, logo, a interação com a BSA contribui para a manutenção das suas propriedades, incluindo as atividades biológicas como antioxidante e de proteção contra doenças como arteriosclerose, cardiovasculares e carcinomas.
A BSA também demonstrou capacidade de interação com a luteína, formando um complexo estável possivelmente capaz de proteger esta importante molécula bioativa contra fotodegradação e oxidação. De acordo com estudo realizado por meio da técnica de fluorescência, a luteína liga-se preferencialmente ao sítio IB da BSA.
Apesar deste ser predominantemente hidrofóbico, resíduos de tirosina (Tir160) e ácido glutâmico (Glu140) formam ligações de hidrogênio com os grupos hidroxilas de cada extremidade da cadeia de polieno da luteína (PAIVA et al., 2020).
Assim, a luteína fica protegida no interior da BSA. Consequentemente, aumenta-se a solubilidade dessa molécula bioativa e, possivelmente, a sua estabilidade sob diversas condições de processamento de alimentos nutracêuticos e fármacos.
(1)Luteína é um corante natural amarelo-laranja da classe das xantofilas, que são carotenoides oxigenados com importantes propriedades bioativas para os seres humanos, principalmente relacionadas à prevenção contra doenças oculares relativas à idade, como degeneração macular e catarata. É geralmente encontrada em vegetais folhosos (por exemplo, espinafre e couve), frutas (manga e melancia) e gema de ovo, e tem sido reconhecida como um interessante corante alimentar para substituir corantes artificiais e desenvolvimento de alimentos funcionais.
Conclusão
Resultados de vários estudos vêm demostrando que a BSA é uma proteína promissora para o transporte e proteção de diversos compostos, com potencial para melhorar a solubilidade e estabilidade de moléculas bioativas durante o processamento e armazenando de alimentos e fármacos.
Entretanto, é importante a intensificação de pesquisas, principalmente relacionadas à fatores que podem alterar a capacidade de complexação da BSA, tais como a presença de diferentes sais (p. ex., os sais caotrópicos e cosmotrópicos da série Hofmeister), variações de pH e de força iônica, além de mudanças conformacionais na proteína (seja por meio de desnaturação térmica ou pelo uso de tecnologias emergentes como o ultrassom).
As propriedades de absorção, distribuição, metabolismo e excreção, assim como a estabilidade dos compostos bioativos, podem ser significativamente afetadas pela interação com a BSA. Diante disso, mais estudos práticos também devem ser conduzidos para compreensão do comportamento do complexo BSA-moléculas bioativas em diferentes matrizes alimentares e em sistemas in vivo.
Gostou do conteúdo? Deixe seu like e seu comentário, isso nos ajuda a saber que conteúdos são mais interessantes para você. Quer escrever para nós? Clique aqui e veja como!
Referências
BOU-ABDALLAH, F. et al. Binding thermodynamics of Diclofenac and Naproxen with human and bovine serum albumins: A calorimetric and spectroscopic study. Journal of Chemical Thermodynamics, v. 103, p. 299–309, 2016.
CARTER, D. C.; HO, J. X. Structure of serum albumin. Advances in Protein Chemistry, v. 45, p. 153-203, 1994.
CHENG, Z. Interaction of ergosterol with bovine serum albumin and human serum albumin by spectroscopic analysis. Molecular Biology Reports, v. 39, n. 10, p. 9493-9508, 2012.
DAWOUD BANI-YASEEN, A. Spectrofluorimetric study on the interaction between antimicrobial drug sulfamethazine and bovine serum albumin. Journal of Luminescence, v. 131, n. 5, p. 1042–1047, 2011.
DIMA, I. G. et al. Binding mechanisms between lycopene extracted from tomato peels and bovine β-lactoglobulin. Journal of Luminescence, v. 203, n. July, p. 582–589, 2018.
ELZOGHBY, A. O.; SAMY, W. M.; ELGINDY, N. A. Protein-based nanocarriers as promising drug and gene delivery systems. Journal of Controlled Release, v. 161, n. 1, p. 38–49, 2012.
HUDSON, E. A. et al. Thermodynamic and kinetic analyses of curcumin and bovine serum albumin binding. Food Chemistry, v. 242, n. June 2017, p. 505–512, 2018.
JAHANBAN-ESFAHLAN, A.; PANAHI-AZAR, V.; SAJEDI, S. Interaction of glutathione with bovine serum albumin: Spectroscopy and molecular docking. Food Chemistry, v. 202, p. 426–431, 2016.
KHODARAHMI, R. et al. Comparative spectroscopic studies on drug binding characteristics and protein surface hydrophobicity of native and modified forms of bovine serum albumin: Possible relevance to change in protein structure/function upon non-enzymatic glycation. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, v. 89, p. 177-186, 2012.
MARSHALL, K. Therapeutic applications of whey protein. Alternative Medicine Review, v. 9, p. 136-56, 2004.
MCCLEMENTS, D.J.; DECKER, E.A. Lipid oxidation in oil-in-water emulsions: Impact of molecular environment on chemical reactions in heterogeneous food systems. Journal of Food Science, v. 65, p. 1270-1282, 2000.
METSÄMUURONEN, S; NYSTRÖM, M. Enrichment of αlactalbumin from with polymeric ultrafiltration membranes. Journal of Membrane Science, v. 337, p. 248-256, 2009.
PAIVA, P. H. C. et al. Influence of protein conformation and selected Hofmeister salts on bovine serum albumin/lutein complex formation. Food Chemistry, v. 305, p. 125463, 2020.
PAN, X. et al. Spectroscopic studies on the interaction of acid yellow with bovine serum albumin. Journal of Luminescence, v. 130, p. 611-617, 2010.
RAHMAN, Y.; AFRIN, S.; TABISH, M. Interaction of pirenzepine with bovine serum albumin and effect of β-cyclodextrin on binding: A biophysical and molecular docking approach. Archives of Biochemistry and Biophysics, v. 652, n. June, p. 27–37, 2018.
SHAHABADI, N.; HADIDI, S. Molecular modeling and spectroscopic studies on the interaction of the chiral drug venlafaxine hydrochloride with bovine serum albumin. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, v. 122, p. 100-106, 2014.
SHAHABADI, N.; MAGHSUDI, M.; ROUHANI, S. Study on the interaction of food colourant quinolone yellow with bovine serum albumin by spectroscopic techniques. Food Chemistry, v. 135, p. 1836–1841, 2012.
SILVA, C. E. L. et al. β-Carotene and milk protein complexation: a thermodynamic approach and a photo stabilization study. Food and Bioprocess Technology, v. 11, n. 3, p. 610–620, 2018.
WALSTRA, P.; WOUTERS, J. T. M.; GEURTS, T. J. Dairy Science and Technology, 2. ed., Taylor & Francis Group, Inc. Broken Sound Parkway, New York, 763 p, 2006.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS