Novo pensamento – involução uterina como um processo inflamatório
A inflamação é um processo importante em indivíduos saudáveis e doentes, que deve ser controlada (Buckley et al., 2011). Muito pouca inflamação em resposta à infecção, por exemplo, leva a uma resposta fracassada frente ao patógeno, um estado de intensificação da doença e possível morte. Muita inflamação leva a dor, inchaço e danos aos tecidos (cicatrizes e fibrose) que podem ter consequências a longo prazo, como perda da função do tecido.
Tanto o útero quanto o fígado estão altamente inflamados nas vacas leiteiras pós-parto (Ribeiro et al., 2016). A inflamação do fígado é causada pelo acúmulo de triglicerídeos nos hepatócitos e o desenvolvimento do fígado gorduroso (Branco, 2015). Um segundo local de inflamação no pós-parto é o útero (LeBlanc, 2014). O descolamento da placenta e a expulsão da placenta e do bezerro causam hemorragia e trauma físico. Ao mesmo tempo, o lúmen do útero é exposto a patógenos ambientais que rapidamente podem causar doença. O dano tecidual e a infecção que ocorre após o parto conduzem a uma resposta inflamatória maciça dentro do útero. Isto é particularmente verdadeiro para vacas que montam uma defesa mal sucedida contra doença e desenvolvem metrite (doença clínica do útero pós-parto).
Em um revisão Karin e Clevers (2016) descreveram como o microbioma do intestino afeta a capacidade do seu epitélio em se regenerar em resposta a lesão ou doença. Lesões e doenças levam à inflamação pela liberação de padrões moleculares associados aos patógenos (PAMPs), padrões moleculares associados ao dano (DAMPs) e espécies reativas de oxigênio (ROS). A liberação de citoquinas das células imunes estimula a proliferação das células tronco e a diferenciação de células adultas. Um modelo similar foi proposto para o útero de vaca pós-parto (Figura 1).
Figura 1. Modelo para a programação da doença uterina pós-parto em vacas.
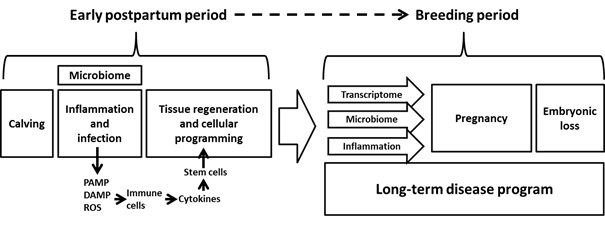
A extensão da resposta inflamatória ao microbioma determina o sucesso do processo regenerativo. Por exemplo, muito pouca inflamação - o tecido pode ficar comprometido; Muita inflamação - o tecido pode tornar-se fibroso (cicatrização, Stramer et al., 2007) ou canceroso (West et al., 2015). Acredita-se que diferentes populações de linhagens celulares se desenvolvem no útero saudável em comparação com o útero doente no pós-parto, dando origem a populações celulares diferentes no endométrio das vacas, dependendo da condição. Este mecanismo dá origem a mudanças de longo prazo no transcriptome do útero e podem afetar a capacidade do útero em estabelecer e também manter uma gestação.
A doença uterina leva à infertilidade a longo prazo
Quase todas as vacas possuem bactérias patogênicas no útero no pós-parto. Algumas vacas desenvolvem metrite (aguda) puerperal, clinicamente diagnosticada por febre, perda de apetite, descarga uterina fetida e inflamação do útero. Outras vacas desenvolvem metrite clínica (descarga fetida sem febre ou perda de apetite) ou endometrite subclínica (inflamação superficial do endométrio). Entre metade a dois terços das vacas permanecem saudáveis (sem doença uterina). As vacas que desenvolvem a doença uterina sofrem de infertilidade a longo prazo (Brick et al., 2012; Giuliodori et al., 2013; Maquivar et al., 2015; Pinedo et al., 2015).
Durante o curso online do Educapoint “Patologias do sistema reprodutivo: doenças uterinas e cistos ovarianos” a professora Dra. Ricarda Santos, além de apresentar uma visão geral sobre doenças uterinas e ovarianas, aborda também, os melhores métodos para prevenção e controle. Saiba mais!
As vacas leiteiras estão imunossuprimidas após o parto. O sistema imunológico deprimido é teoricamente causado pelo estado homeorrético endócrino e metabólico que suporta o início da lactação (revisado por Lucy et al., 2014). A incapacidade de resolver a doença uterina leva à inflamação que pode danificar o tecido uterino. Embora os sintomas da metrite possam ser tratados com antimicrobianos, a literatura é equívoca em responder se o tratamento de uma vaca para a metrite afeta a fertilidade pós-parto (LeBlanc, 2008; Haimerl e Heuwieser, 2014; LeBlanc, 2014).
Em uma revisão, Haimerl e Heuwieser (2014) observaram que nenhum dos 17 estudos com o antimicrobiano ceftiofur demonstrou melhor desempenho reprodutivo após o tratamento. Isso pode ser porque o tratamento antimicrobiano no pós-parto precoce não visa os mecanismos ou células que causam infertilidade a longo prazo. É necessário que sejam desenvolvidos novos tratamentos que atuem sobre a inflamação no tecido uterino. Esses tratamentos poderiam potencialmente curar a vaca da infertilidade de longo prazo associada à metrite.
Alguns dos agentes patogênicos que infectam o útero podem vir da própria gestação
As espécies predominantes em vacas com metrite são Trueperella pyogenes (T. pyogenes), Escherichia coli (E. coli), Fusobacterium necrophorum (F. necrophorum) e Prevotella melaninogenica (P. melaninogenica) (Carneiro et al., 2016). Essas espécies bacterianas são encontradas no ambiente e acredita-se que tenham acesso ao ambiente uterino no parto da vaca (Bromfield et al., 2015). As bactérias que causam metrite são parte do microbioma bovino normal e não são patogênicas quando encontradas fora do útero.
Por exemplo, T. pyogenes é encontrado na nasofaringe; E. coli no intestino; F. necrophorum no rúmen; e P. melaninogenica é parte da flora normal oral e vaginal. As bactérias que causam o aborto são conhecidas por ter acesso à gestação por uma via hematogênica de infecção ou por infecção ascendente da vagina (Yaeger e Holler, 2007).
Algumas das bactérias que causam metrite podem residir no útero como parte do microbioma placentário. Lucy em colaboração com Aaron Ericsson da Missouri University [Diretor do MU Centro de Metagenomica], em um cesariana coletaram amostras do útero grávido e do bezerro recém-nascido (mecônio). Eles usaram fezes bovinas e papilas de rúmen como amostras de controle positivo.
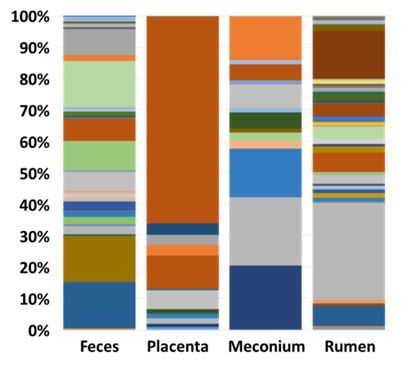
O Centro de Metagenomica gerou e sequenciou 16S rRNA amplicons para caracterizar a taxonomia bacterina. Eles descobriram que as bactérias que foram identificadas no útero grávido [Bacteroidetes (inclui Prevotella sp.) e Firmicutes (inclui Oscillospira sp.)] foram semelhantes às que foram identificadas em vacas com metrite no pós-parto por Santos e Bicalho (2012) em estudos de metagenômica (Figura 2). Esses novos dados demonstram que existe um microbioma associado à gestação bovina. Este microbioma pode contribuir para os agentes patogênicos que causam doença pós-parto.
Figura 2. Dados metagenômicos para fezes, placenta, mecônio e rúmen gerados pelo Centro de Metagenomica da MU (MUMC). Como esperado, as fezes e o rúmen continham um microbioma abundante e diversificado. Havia também bactérias na placenta e no mecônio. A principal unidade taxonômica operacional (OTU) identificada na placenta foi Mycoplasma haemobos, que representou 66% das sequências. Mycoplasma haemobos foi encontrado apenas na placenta. As bactérias primárias do mecônio foram Bacteroides sp., Prevotella sp., e Oscillospira sp.
A impressão imunológica da doença uterina pós-parto na função uterina pós-parto
Recentemente foi publicado um artigo sobre focos linfocíticos no endométrio bovino de vacas leiteiras pós-parto (Lucy et al., 2016). A presença desses focos linfocíticos no útero gestante, por volta de 100 dias pós-parto foi associada a inflamação crônica. O número de focos pequenos e intermediários encontrados nos cortes histológicos foi maior nas vacas com infecção uterina pós-parto.
Os focos estavam distribuídos nas carúnculas e no tecido intercaruncular e compreendiam células CD3 positivas (células T) envolvendo células CD79 positivas (células B). Eles eram semelhantes, portanto, às estruturas linfoides terciárias atualmente investigadas em outros tecidos (Leslie, 2016). Alguns compararam essas estruturas com as unidades de Hospitais Cirúrgicos do Exército Móvel, que estão posicionadas perto dos campos de batalha imunológica. As vacas com alta contagem de focos tinham menor peso placentário no dia 42 da gestação.
Duas vacas com perda embrionária estavam no quartil mais alto para a contagem desses focos. A associação de focos com perda embrionária é consistente com a bem conhecida biologia clínica da égua, onde a inflamação crônica que inclui focos linfocíticos leva a infertilidade e perda embrionária precoce (Evans et al., 2007). Se os focos estão associados com um microbioma único ou transcriptome uterino alterado é um dos assuntos que devem ser abordados em trabalhos futuros. Acredita-se que a inflamação crônica do útero é uma das principais causas de perda embrionária precoce em vacas leiteiras.
Conclusão
O ambiente endócrino e metabólico da vaca em lactação afeta a capacidade da mesma para reconceber no pós-parto. Há uma ampla evidência de que os hormônios responsáveis pelos mecanismos homeorréticos que suportam o início da lactação também podem atuar sobre o ovário e o útero, afetando sua função antes e durante o período reprodutivo.
Além do ambiente hormonal, o ambiente metabólico criado pela lactação que inclui baixa concentração de glicose, NEFA e BHBA elevados no sangue atingem o ovário, bem como o sistema imunológico, que desempenha um papel crítico na restauração da saúde uterina na vaca pós-parto. O mecanismo específico pelo qual o ambiente metabólico da lactação inicial deposita uma impressão duradoura na função ovariana e uterina não é claro. Também não são claros os mecanismos que ligam a lactação a uma predisposição para perda de gestação. A inflamação uterina em vacas de leite pode ser um mecanismo importante para explicar a perda da gestação observada nas mesmas.
Confira a I parte deste artigo publicado no dia 05/05/2017 clicando aqui.
Referências bibliográficas
Bauman DE, Currie WB. 1980. Partitioning of nutrients during pregnancy and lactation: a review of mechanisms involving homeostasis and homeorhesis. J. Dairy Sci. 63:1514-1529.
Brick TA, Schuenemann GM, Bas S, Daniels JB, Pinto CR, Rings DM, Rajala-Schultz PJ. 2012. Effect of intrauterine dextrose or antibiotic therapy on reproductive performance of lactating dairy cows diagnosed with clinical endometritis. J Dairy Sci 95:1894-1905.
Bromfield JJ, Santos JE, Block J, Williams RS, Sheldon IM. 2015. PHYSIOLOGY AND ENDOCRINOLOGY SYMPOSIUM: Uterine infection: linking infection and innate immunity with infertility in the high-producing dairy cow. J Anim Sci. 93:2021-33.
Buckley CD, Gilroy DW, Serhan CN, Stockinger B, Tak PP. 2013. The resolution of inflammation. Nat Rev Immunol 13:59-66.
Butler ST, Bork AL, Pelton SH, Radcliff RP, Lucy MC, and Butler WR. 2003. Insulin restores hepatic growth hormone (GH) responsiveness during lactation-induced negative energy balance in dairy cattle: effects on expression of insulin-like growth factor-I and GH receptor 1A. J. Endocrinol. 176:205-217.
Carneiro LC, Cronin JG, Sheldon IM. 2016. Mechanisms linking bacterial infections of the bovine endometrium to disease and infertility. Reprod Biol. 16:1-7.
Castro N, Kawashima C, van Dorland HA, Morel I, Miyamoto A, Bruckmaier RM. 2012. Metabolic and energy status during the dry period is crucial for the resumption of ovarian activity postpartum in dairy cows. J. Dairy Sci. 95:5804-5812.
Chapinal N, Leblanc SJ, Carson ME, Leslie KE, Godden S, Capel M, Santos JE, Overton MW, Duffield TF. 2012. Herd-level association of serum metabolites in the transition period with disease, milk production, and early lactation reproductive performance. J. Dairy Sci. 95:5676-5682.
Evans TJ, Constantinescu GM, Ganjam VK. 2007. Clincal reproductive anatomy and physiology of the mare. In: Youngquist RS, Threlfall WR, editors. Large Animal Theriogenology, St. Louis: Saunders Elsevier; p. 47-67.
Galvão KN, Flaminio MJ, Brittin SB, Sper R, Fraga M, Caixeta L, Ricci A, Guard CL, Butler WR, Gilbert RO. 2010. Association between uterine disease and indicators of neutrophil and systemic energy status in lactating Holstein cows. J. Dairy Sci. 93:2926-2937.
Giuliodori MJ, Magnasco RP, Becu-Villalobos D, Lacau-Mengido IM, Risco CA, de la Sota RL. 2013. Metritis in dairy cows: risk factors and reproductive performance. J Dairy Sci 96:3621-3631.
Graugnard DE, Bionaz M, Trevisi E, Moyes KM, Salak-Johnson JL, Wallace RL, Drackley JK, Bertoni G, Loor JJ. 2012. Blood immunometabolic indices and polymorphonuclear neutrophil function in peripartum dairy cows are altered by level of dietary energy prepartum. J. Dairy Sci. 95:1749-1758.
Haimerl P, Heuwieser W. 2014. Invited review: Antibiotic treatment of metritis in dairy cows: a systematic approach. J Dairy Sci 97:6649-61.
Karin M, Clevers H. 2016. Reparative inflammation takes charge of tissue regeneration. Nature 529:307-15.
Kawashima C, Matsui M, Shimizu T, Kida K, Miyamoto A. 2012. Nutritional factors that regulate ovulation of the dominant follicle during the first follicular wave postpartum in high-producing dairy cows. J. Reprod. Devel. 58:10-16.
LeBlanc SJ. 2008. Postpartum uterine disease and dairy herd reproductive performance: a review. Vet J 176:102-114.
LeBlanc SJ. 2014 Reproductive tract inflammatory disease in postpartum dairy cows. Animal 8 Suppl 1:54-63.
LeBlanc SJ. 2012. Interactions of metabolism, inflammation, and reproductive tract health in the postpartum period in dairy cattle. Reprod. Domest. Anim. 47 Suppl 5:18-30.
LeBlanc SJ, Osawa T, Dubuc J. 2011. Reproductive tract defense and disease in postpartum dairy cows. Theriogenology 76:1610-1618.
Leroy JL, Rizos D, Sturmey R, Bossaert P, Gutierrez-Adan A, Van Hoeck V, Valckx S, Bols PE. 2011. Intrafollicular conditions as a major link between maternal metabolism and oocyte quality: a focus on dairy cow fertility. Reprod. Fertil. Devel. 24:1-12.
Leroy JL, Vanholder T, Van Knegsel AT, Garcia-Ispierto I, Bols PE. 2008. Nutrient prioritization in dairy cows early postpartum: mismatch between metabolism and fertility? Reprod. Domest. Anim. 43 Suppl 2:96-103.
Leslie M. 2016. Immunity goes local. Science 352(6281):21-3.
Lucy MC, Butler ST, Garverick HA. 2014. Endocrine and metabolic mechanisms linking postpartum glucose with early embryonic and foetal development in dairy cows. Animal 8 Suppl 1:82-90.
Lucy MC, Evans TJ, Poock SE. 2016. Lymphocytic foci in the endometrium of pregnant dairy cows: Characterization and association with reduced placental weight and embryonic loss. Theriogenology 86:1711-1719.
Lucy MC. 2008. Functional differences in the growth hormone and insulin-like growth factor axis in cattle and pigs: implications for post-partum nutrition and reproduction. Reprod. Domest. Anim. 43:31-39.
Lucy MC. 2011. Growth hormone regulation of follicular growth. Reprod. Fertil. Devel. 24:19-28.
Lucy MC, Escalante RC, Keisler DH, Lamberson WR, Mathew DJ. 2013. Short communication: Glucose infusion into early postpartum cows defines an upper physiological set point for blood glucose and causes rapid and reversible changes in blood hormones and metabolites. J. Dairy Sci. 96:5762-5768.
Maquivar MG, Barragan AA, Velez JS, Bothe H, Schuenemann GM. 2015. Effect of intrauterine dextrose on reproductive performance of lactating dairy cows diagnosed with purulent vaginal discharge under certified organic management. J Dairy Sci 98:3876-3886.
Moyes KM, Larsen T, Ingvartsen KL. 2013. Generation of an index for physiological imbalance and its use as a predictor of primary disease in dairy cows during early lactation. J. Dairy Sci. 96:2161-2170.
Pinedo PJ, Velez JS, Bothe H, Merchan D, Piñeiro JM, Risco CA. 2015. Effect of intrauterine infusion of an organic-certified product on uterine health, survival, and fertility of dairy cows with toxic puerperal metritis. J Dairy Sci. 98:3120-3132.
Ribeiro ES, Gomes G, Greco LF, Cerri RL, Vieira-Neto A, Monteiro PL Jr, Lima FS, Bisinotto RS, Thatcher WW, Santos JE. 2016. Carryover effect of postpartum inflammatory diseases on developmental biology and fertility in lactating dairy cows. J Dairy Sci. 99:2201-2220.
Santos TM, Bicalho RC. 2012. Diversity and succession of bacterial communities in the uterine fluid of postpartum metritic, endometritic and healthy dairy cows. PLoS One 7:e53048.
Stramer BM, Mori R, Martin P. 2007. The inflammation-fibrosis link? A Jekyll and Hyde role for blood cells during wound repair. J Invest Dermatol 127:1009-17.
Velazquez MA, Spicer LJ, Wathes DC. 2008. The role of endocrine insulin-like growth factor-I (IGF-I) in female bovine reproduction. Domest. Anim. Endocrinol. 35:325-342.
Wathes DC. 2012. Mechanisms linking metabolic status and disease with reproductive outcome in the dairy cow. Reprod. Domest. Anim. 47 Suppl 4:304-312.
West NR, McCuaig S, Franchini F, Powrie F. 2015. Emerging cytokine networks in colorectal cancer. Nat Rev Immunol 15:615-29.
White HM. 2015. The Role of TCA Cycle Anaplerosis in Ketosis and Fatty Liver in Periparturient Dairy Cows. Animals (Basel) 5:793-802.
Yaeger MJ, Holler LD. 2007. Bacterial causes of bovine infertility and abortion. In: Youngquist RS, Threlfall WR, editors. Large Animal Theriogenology, St. Louis: Saunders Elsevier; pp. 389-408.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS













