Introdução
Luteólise é definida como a perda da função do corpo lúteo (CL) e sua regressão ou involução, que encerra o ciclo estral de vacas (McCracken et al, 1999;. Niswender et al, 2000). Luteólise é caracterizada por dois eventos. No primeiro evento há diminuição da secreção de progesterona (P4) que é conhecida como luteólise funcional. Após a luteólise funcional, ocorre a luteólise estrutural ou morfológica, que é a perda da estrutura celular do corpo lúteo e sua involução gradual em corpus albicans (McCracken et al;. 1999; Niswender et al, 2000). Luteólise natural é iniciado pela secreção pulsátil intermitente de prostaglandina F2α (PGF) a partir do útero (Kindahl et al, 1976b;. Mann e Lamming, 2006). A PGF entra na artéria ovariana da veia útero-ovariana por um mecanismo de transferência contra-corrente e parece agir localmente no corpo lúteo para dar início a luteólise (McCracken et al., 1999). Este mecanismo é essencial para a luteólise natural, pois aproximadamente 65% da PGF endógena é metabolizada durante uma passagem através da circulação pulmonar (Davis et al., 1985).
Quando a PGF é utilizada em bovinos para induzir a luteólise, uma única injeção intramuscular precisa ter a mesma eficácia dos pulsos de PGF uterina, atuando localmente no CL para induzir a luteólise funcional e estrutural. No entanto, neste caso, a PGF vai passar pela circulação sistêmica antes de começar sua ação local. Portanto, grandes doses de PGF natural (dinoprost) ou potente análogos resistentes ao metabolismo endógeno (cloprostenol) são necessários para causar uma luteólise eficaz induzida por PGF em bovinos. Brusveen et al. (2009) definiu luteólise efetiva ou completa, após PGF do Ovsynch, como uma queda nas concentrações séricas de progesterona a níveis basais após 2 d da injeção de PGF.
Dados recentes indicaram que uma grande proporção de vacas tratadas com o protocolo Ovsynch (GnRH - 7 dias - PG - 2 dias - GnRH - 16 horas - IATF) ou variações de Ovsynch têm poucas chances de concepção se as concentrações de P4 não diminuirem para menos de 0,5 ng/mL em 2 dias após a PGF do Ovsynch. Aproximadamente 20% das vacas tratadas com Ovsynch estão nesta categoria e, apesar de um possível sucesso de sincronização da ovulação, poucas destas vacas emprenham (5%). Assim, este trabalho irá discutir como acelerando a redução de concentrações de P4 durante a luteólise induzida por PGF do Ovsynch pode melhorar a fertilidade de vacas tratadas com Ovsynch (Brusveen et al., 2009).
Ovsynch e luteólise
Prostaglandina F2α (25 mg de dinoprost ou 0,5 mg de cloprostenol) no protocolo Ovsynch é administrado para induzir a regressão de corpos lúteos (luteólise), permitindo assim, que o folículo dominante da nova onda folicular se transforme em um folículo ovulatório. Se as concentrações séricas de P4 não reduzirem para < 0,5 ng /mL em 2 dias após o tratamento, as chances de concepção após IATF do Ovsynch são reduzidas significativamente (Souza et al, 2007; Brusveen et al, 2009). Assim, uma rápida queda nas concentrações séricas de P4 após a injeção de PGF é vital para o sucesso do protocolo Ovsynch. A queda nas concentrações séricas para < 0,5 ng/mL em 2 d após a injeção de PGF caracteriza a luteólise completa.
Quando Ovsynch é usado com um protocolo de pré-sincronização, como G6G (Fig. 4), na maioria dos casos, no momento da PGF haverá pelo menos dois CL para regredir, um CL de 13 d de idade (CL 13 d) e um CL de 7 d de idade (CL 7 d). Não se sabe se o número de CL pode afetar a porcentagem de vacas com luteólise completa após a PGF do Ovsynch. No entanto, a maturidade destes CL pode desempenhar papel fundamental na eficácia do processo de luteólise (Skarzynski et al, 2008).
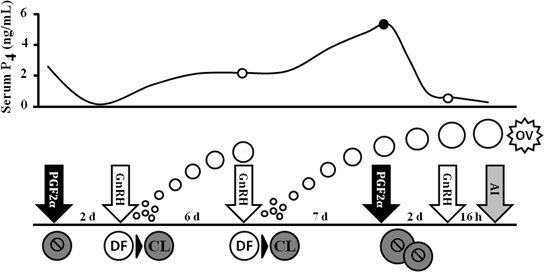
Fig. 4. Descrição do controle do desenvolvimento folicular e do CL utilizando um sistema simples de pré-sincronização com PGF-GnRH (G6G), explicando como o início do Ovsynch no dia 6 do ciclo estral induz um CL acessório e aumenta P4 antes da luteólise induzida por PGF.
O CL é refratário a uma dose luteolítica de PGF durante os primeiros 5 dias do ciclo estral (Lauderdale et al., 2009). Esta resistência durante a fase inicial de desenvolvimento do CL pode ser devido à falta de expressão de mediadores responsáveis pela luteólise (McCracken et al., 1999), mesmo que receptores para PGF já terem sido detectados em CL de 3 e 4 dias de idade (Sakamoto et al. 1995; Wiltbank et al. 1995). Uma parte do CL de 7d formado durante uma pré-sincronização + Ovsynch pode ser menos maturo. Não é totalmente claro o porque disso. Mas uma possível explicação seria que alguns folículos ovulatórios que formaram os CL poderiam ser menores no momento da ovulação do que a média. Portanto, suspeita-se que um CL de 7d pode ser um CL com menor probabilidade de regressão completa em comparação com um CL de 13d. No entanto, essa hipótese precisa ser testada.
A alta porcentagem de vacas que não têm luteólise completa após a PGF do Ovsynch parece ser um problema neste protocolo e varia entre os estudos de 5 a 20% (Pursley et al, 1997b; Moreira et al, 2000; Gumen et al, 2003; Brusveen et al, 2009). Brusveen et al. (2009) utilizaram duas injeções de PGF, com um intervalo de 24 h entre doses, no protocolo Ovsynch com o objetivo de aumentar a porcentagem de vacas com luteólise completa. Vacas tratadas com duas injeções de PGF tiveram redução significativa (P<0,001) na porcentagem de vacas com luteólise incompleta em comparação com vacas tratadas com uma única injeção (2,5% vs 14%, respectivamente).
Quando Ovsynch é iniciado no final do ciclo estral, há grande probabilidade de que o CL possa sofrer luteólise natural antes da PGF. As vacas nessa situação podem ter um estro natural e ovular antecipadamente (antes da IATF). Se essas vacas não forem detectadas em estro neste momento (geralmente em torno do momento da aplicação da PGF), elas serão inseminadas na IATF. Com isso, as taxas de concepção da IATF destas vacas serão significativamente menores, devido a assincronia da IA e ovulação, ou seja, a IATF ocorrerá depois da ovulação.
Descrição farmacológica dos análogos da PGF aprovados para luteólise em bovinos
Atualmente, as únicas PGF disponíveis comercialmente nos EUA são dinoprost thrometamina e cloprostenol sódico. Dinoprost trometamina foi desenvolvido no início dos anos 1970 (Lauderdale, 2009). O alto custo desta substância durante aquela época foi uma razão pela qual análogos desta substância, como cloprostenol sódico foram desenvolvidos (Cooper e Furr, 1974; Dobson, 1975; Lagar, 1977). Cloprostenol sódico (0,5 mg) tem uma dose eficaz, que é 50 vezes menor do que dinoprost trometamina (25 mg; Cooper e Furr, 1974). Mesmo que esta dose menor tenha a mesma potência, Cooper e Furr (1974) concluíram que o cloprostenol sódico tem grande margem de segurança em bovinos. Uma injeção intramuscular com uma dose 200 vezes maior que a dose efetiva produziu poucos efeitos secundários.
Uma das prováveis explicações para que haja uma diferença extrema na dose efetiva é pela forma como estes compostos são metabolizados uma vez que estejam na circulação. A meia-vida do dinoprost trometamina na circulação sistêmica é cerca de 7 ~ 8 minutos (Kindahl et al., 1976a). Aproximadamente 65% da dose injetada é metabolizada em apenas uma passagem pelos pulmões (Davis et al, 1985;. McCracken et al, 1999). Doses menores (5 mg) de dinoprost trometamina administrado através de infusão (ipsilateral ao corpo lúteo) intra-uterina parecem ser tão eficazes quanto as injeções intramusculares. Por outro lado, esta via não é adequada para o tratamento de um grande número de vacas pois seria necessário muito tempo para realizar esta tarefa, tornando esta via inviável.
O cloprostenol sódico tem uma meia vida muito mais longa em comparação com o dinoprost trometamina (3 h vs 7 ~ 8 min;. Kindahl et al, 1976a; Reeves, 1978). A razão para a maior resistência ao metabolismo endógeno é a presença de um anel de cloro benzílico que bloqueia e/ou reduz a ação das enzimas responsáveis pelo metabolismo da PGF (Bourne et al., 1980).
Comparação entre cloprostenol sódico e dinoprost trometamina em bovinos
Poucos estudos durante os últimos 30 anos compararam o uso de cloprostenol sódico e dinoprost trometamina em gado de corte e de leite (Furr et al, 1981;. Sudweeks et al, 1983;. Seguin et al, 1985;. Turner et al, 1987;. Salverson et al, 2002;. Hiers et al, 2003. ; Martineau, 2003; Répási et al, 2005;. Esterman et al, 2009;. Stevenson e Phatak, 2010). As diferenças no desempenho reprodutivo entre estes dois análogos da PGF foram inconsistentes nestes estudos. Os resultados variaram entre o aumento na expressão de estro em favor de cloprostenol sódico ou nenhuma diferença na expressão de estro ou taxas de concepção entre os produtos.
Estudos recentes
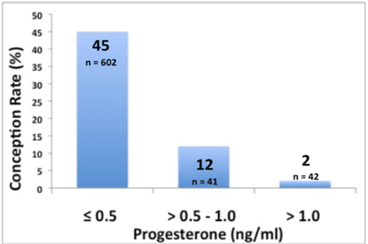
Fig. 5. Taxa de concepção em vacas em lactação (n=685) com P4 >2.5 ng/mL no dia da PGF do Ovsynch e que em 2 dias depois diminuíram para ≤0.5 ou >0.5 - 1*, ou >1ng/mL
*Todas as vacas nesse grupo tiveram uma eventual regressão do CL com P4 < 0.2 ng/mL 4 dias depois da PGF do Ovsynch.
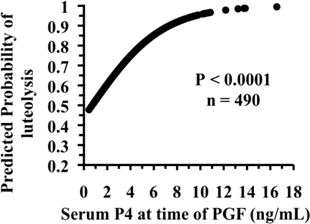
Fig. 6. Relação entre concentrações de P4 sérica no momento da PGF do Ovsynch e a probabilidade prevista de luteólise em vacas de leite em lactação.
Dados combinados de quatro estudos recentes (Bello et al., 2006; Stevenson et al., 2006), indicam que a regressão lútea insuficiente (definida como P4 sérica > 0,5 ng/mL 56h após a PGF) durante Ovsynch está relacionado com taxas de concepção muito baixas.
Vacas com luteólise insuficiente tiveram taxas de concepção muito menores que vacas com luteólise completa (com concentrações de P4 < 0,5 ng/mL 56h após a PGF; Fig. 5). Até 23% das vacas tratadas com Ovsynch no primeiro serviço tiveram luteólise incompleta ou insuficiente.
Além disso, novos dados indicam que quanto maiores as concentrações de P4 no momento da PGF, maiores são as chances de luteólise completa (Fig. 6). Portanto, existem várias razões para aumentar P4 antes da PGF do Ovsynch, e, aparentemente, elas são independentes umas das outras quanta ao seu impacto na fertilidade. Assim, a amplificação da luteólise induzida por PGF do Ovsynch é fundamental para melhorar a fertilidade de vacas submetidas a esse programa.
Dados preliminares, mostraram que 3 dentre 12 vacas em lactação tardia com um CL imaturo de 5 dias de idade responderam a uma dose única de dinoprost. Enquanto 12 dentre 12 vacas tratadas com duas doses de dinoprost com um intervalo de 12 h entre doses, tiveram regressão completa do CL. Outros dados da literatura (Brusveen et al., 2009), indicaram que a luteólise pode ser acelerada com múltiplas injeções de PGF no programa Ovsynch. No entanto, neste estudo, as doses de PGF foram administradas com intervalos de 24 h. Não está claro na literatura se uma rápida diminuição de P4 induzida por múltiplas injeções de PGF em um curto período de tempo poderia aumentar a fertilidade de vacas leiteiras. A razão pela qual a luteólise induzida por PGF no Ovsynch é atenuada ou incompleta em alguns animais é desconhecida. Mas pode ser atribuída, mais uma vez, à resposta inadequada do CL acessório presente na hora dos tratamentos de PGF.
Evidências de luteólise prejudicada em resposta à PGF do Ovsynch
Apesar dos efeitos benéficos das concentrações de P4 aumentadas nas taxas de concepção (Fig. 2), dados na fig. 3 indicam que a luteólise insuficiente limita a fertilidade potencial do programa Ovsynch. Esta luteólise insuficiente pode ser agravada pela presença de um CL acessório jovem, com 7 dias de idade no momento da PGF do Ovsynch, e possivelmente muito imaturo para regredir totalmente com uma única dose de PGF (McCracken et al., 1999; Levy et al., 2001) . Em estudo mais recente, apenas 77% das vacas com CL funcional no dia da PGF do Ovsynch tiveram diminuição de P4 para < 0,5 ng/mL 56 h depois (no momento do GnRH final). Dados preliminares (descritos acima) indicam que pode-se acelerar o processo luteolítico pela administração de injeções múltiplas PGF.
Conclusão
O manejo reprodutivo de vacas leiteiras é o principal fator que contribui para a rentabilidade, eficiência e sustentabilidade de fazendas leiteiras (USDA, 2002). As estimativas de perdas econômicas nos EUA devido à ineficiência reprodutiva variam de 1 a 5 bilhões de dólares por ano (Nebel and McGilliard, 1993). Devido a tendência de queda nas taxas de concepção ao longo dos últimos 50 anos nos EUA (Lucy, 2001; Washburn et al., 2002) pode-se prever que a fertilidade de vacas em lactação continuará a ser um desafio fundamental para um manejo rentável do rebanho leiteiro. Estratégias de IATF que utilizam a tecnologia Ovsynch podem melhorar as taxas de prenhez em vacas em lactação por aumentar a taxa de serviço (Pursley et al., 1997).
No entanto, o aumento das taxas de concepção utilizando Ovsynch poderia melhorar significativamente a eficácia deste protocolo (Vasconcelos et al., 1999; Navanukraw et al., 2004). Com essa finalidade, muitos pesquisadores trabalham em modificações no programa Ovsynch que visam aumentar P4 antes da PGF e amplificar a queda da P4 após a indução de luteólise. Essas modificações são baseadas em novos dados convincentes indicando que ambos melhoram significativamente as taxas de concepção ao 1º serviço após o Ovsynch.
Como o Ovsynch tradicional já está em vigor nos sistemas de manejos de fazendas de leite em todo o mundo, as melhorias estratégicas no Ovsynch têm potencial para ser aplicado na indústria de uma forma simples e sem problemas (apesar da complexidade de reforçar este programa para melhorar a fertilidade). Com essas mudanças no protocolo Ovsynch (aumentando as concentrações de P4 antes da PGF e acelerando a luteólise induzida pela PGF), as taxas de concepção poderiam melhorar 30 pontos percentuais (passando de ~30% para 60). Este aumento de 30 pontos percentuais das taxas de concepção no 1º serviço poderia aumentar o lucro em US$ 65.000/ano em uma fazenda de leite com 500 vacas em lactação (Olynk and Wolf, 2009).
Referências
Bello NM, Steibel JP, Pursley JR. Optimizing Ovulation to 1st GnRH Improved Outcomes to Each Hormonal Injection of Ovsynch in Lactating Dairy Cows. Journal of Dairy Science 2006; 89: 3413-3424.
Bourne, G. R., S. R. Moss, P. J. Phillips, and B. Shuker. 1980. The metabolic fate of the synthetic prostaglandin cloprostenol (´Estrumate´) in the cow: use of ion cluster techniques to facilitate metabolite identification. Biomed. Mass Spec. 7(5):226-230.
Brusveen, D. J., A. H. Souza, and M. C. Wiltbank. 2009. Effects of additional prostaglandin F2alpha and estradiol-17beta during Ovsynch in lactating dairy cows. J. Dairy Sci. 92(4):1412-1422.
Cooper, M. J. and B. J. Furr. 1974. Proceedings: The role of prostaglandins in animal breeding. Vet. Rec. 94(8):161.
Davis, A. J., I. R. Fleet, P. A. Hansford, F. A. Harrison, and F. M. M. Walker. 1985. Pulmonary metabolism of prostaglandin F2alpha in the conscious non-pregnant cow. J. Physiol. 358(suppl):107P.
Dobson, H., M. J. Cooper, and B. J. Furr. 1975. Synchronization of oestrus with I.C.I. 79,939, an analogue of PGF2alpha, and associated changes in plasma progesterone, oestradiol-17beta and LH in heifers. J. Reprod. Fertil. 42(1):141-144.
Esterman, R., B. Austin, S. Woodall, E. McKinniss, and J. Yelich. 2009. Effectiveness of cloprostenol sodium vs. dinoprost tromethamine in a GnRH/CIDR + PGF2α synchronization protocol in Angus, Brahmans, and Brahman x Angus cows. Pages 63-68 in Florida Beef Report.
Furr, B. J. A., M. J. Cooper, P. S. Jackson, I. C. Hart, and G. S. Pope. 1981. Effects of cloprostenol and prostaglandin F2α on secretion of follicle stimulating hormone, luteinizing hormone, prolactin, growth hormone, thyroxine and cortisol in heifers. Acta Vet. Scand. Suppl. 77:55-69.
Gümen, A., J. N. Guenther, and M. C. Wiltbank. 2003. Follicular size and response to Ovsynch versus detection of estrus in anovular and ovular lactating dairy cows. J. Dairy Sci. 86(10):3184-3194.
Hiers, E. A., C. R. Barthle, M. K. Dahms, G. E. Portillo, G. A. Bridges, D. O. Rae, W. W. Thatcher, and J. V. Yelich. 2003. Synchronization of Bos indicus x Bos taurus cows for timed artificial insemination using gonadotropin-releasing hormone plus prostaglandin F2alpha in combination with melengestrol acetate. J. Anim. Sci. 81(4):830-835.
Kindahl, H., L. E. Edquist, A. Bane, and E. Granstrom. 1976a. Blood levels of progesterone and 15-keto-13,14-dihydro-prostaglandin F2alpha during the normal oestrous cycle and early pregnancy in heifers. Acta Endocrinol. (Copenh) 82:134-149.
Kindahl, H., L. E. Edquist, E. Granstrom, and A. Bane. 1976b. The release of prostaglandin F2alpha as reflected by 15-keto-13,14-dihydroprostaglandin F2alpha in the peripheral circulation during normal luteolysis in heifers. Prostaglandins 11:871-878.
Lagar, J. J. 1977. Synchronization of the estrous cycle with prostaglandin F2 alpha for use of artificial insemination in cattle (a review). Vet. Med. Small Anim. Clin. 72(1):87-92.
Lauderdale, J. W. 2009. Contributions in the Journal of Animal Science to the development of protocols for breeding management of cattle through synchronization of estrus and ovulation. J. Anim. Sci. 87:801-812.
Levy N, Gordin M, Mamluk R, Yanagisawa M, Smith MF, Hampton JH, Meidan R. Distinct Cellular Localization and Regulation of Endothelin-1 and Endothelin-Converting Enzyme-1 Expression in the Bovine Corpus Luteum: Implications for Luteolysis. Endocrinology 2001; 142: 5254-5260.
Lucy MC. Reproductive loss in high-producing dairy cattle: where will it end? Journal of Dairy Science 2001; 84: 1277-1293.
Mann G. E. and G. E. Lamming. 2006. Timing of prostaglandin F(2alpha) release episodes and oxytocin receptor development during luteolysis in the cow. Anim. Reprod. Sci. 93:328-336.
Martineau, R. 2003. Dinoprost versus Cloprostenol: Does route of injection modulate their efficacy in dairy cattle. Bov. Pract. 37:10-19.
McCracken, J. A., E. E. Custer, and J. C. Lamsa. 1999. Luteolysis: a neuroendocrine-mediated event. Physiol. Rev. 79(2):263-323.
Moreira, F., C. A. Risco, M. F. Pires, J. D. Ambrose, M. Drost, and W. W. Thatcher. 2000. Use of bovine somatotropin in lactating dairy cows receiving timed artificial insemination. J. Dairy Sci. 83(6):1237-1247.
Nebel RL, McGilliard ML. Interactions of high milk yield and reproductive performance in dairy cows. J. Dairy Sci. 1993; 76: 3257-3268.
Navanukraw C, Redmer DA, Reynolds LP, Kirsch JD, Grazul-Bilska AT, Fricke PM. A modified presynchronization protocol improves fertility to timed artificial insemination in lactating dairy cows. J. Dairy Sci. 2004; 87: 1551-1557.
Niswender G.D., J.L. Juengel, P.J. Silva, M.K. Rollyson, and E.W. McIntush. 2000. Mechanisms controlling the function and life span of the corpus luteum. Physiol. Rev. 80:1-29.
Olynk NJ, Wolf CA. Stochastic economic analysis of dairy cattle artificial insemination reproductive management programs. J Dairy Sci 2009; 92: 1290-1299.
Pursley, J. R., M. C. Wiltbank, J. S. Stevenson, J. S. Ottobre, H. A. Garverick, and L. L. Anderson. 1997. Pregnancy rates per artificial insemination for cows and heifers inseminated at a synchronized ovulation or synchronized estrus. J. Dairy Sci. 80(2):295-300.
Reeves, P. R. 1978. Distribution, elimination, and residue studies in the cow with the synthetic prostaglandin estrumate. J. Agric. Food Chem. 26(1):152-155.
Répási, A., J. Beckers, J. Sulon, A. Karen, J. Reiczigel, and O. Szenci. 2005. Effect of the type and number of prostaglandin treatments on corpus luteum, the largest follicle and progesterone concentration in dairy cows. Reprod. Domest. Anim. 40(5):436-442.
Sakamoto K, Miwa K, Ezashi T, Okuda-Ashitaka E, Okuda K, Houtani T, Sugimoto T, Ito S, and Hayaishi O. 1995. Expression of mRNA encoding the PGF2a receptor in bovine corpora lutea throughout the ooestrous cycle and pregnancy. J. Reprod. Fertil. 103:99-105.
Salverson, R. R., J. M. DeJarnette, C. E. Marshall, and R. A. Wallace. 2002. Synchronization of estrus in virgin beef heifers using melengestrol acetate and PGF2α: an efficacy comparison of cloprostenol and dinoprost tromethamine. Theriogenology 57(2):853-858.
Seguin, B., H. Momont, and L. Baumann. 1985. Cloprostenol and dinoprost tromethamine in experimental and field trials treating unobserved estrus in dairy cows. Bov. Pract. 20:85-90.
Skarzynski D.J., G. M. Ferreira-Dias, and K. Okuda. 2008. Regulation of luteal function and corpus luteum regression: hormonal control, immune mechanisms, and inter-cellular communication. Reprod. Domest. Anim. 43(2):57-65.
Souza, A. H., A. Gumen, E. P. Silva, A. P. Cunha, J. N. Guenther, C. M. Peto, D. Z. Caraviello, and M. C. Wiltbank. 2007. Supplementation with estradiol-17beta before the last gonadotropin-releasing hormone injection of the Ovsynch protocol in lactating dairy cows. J. Dairy Sci. 90(10):4623-4634.
Stevenson, J. S. and A. P. Phatak. 2010. Rates of luteolysis and pregnancy in dairy cows after treatment with cloprostenol or dinoprost. Theriogenology 73(8):1127-1138.
Stevenson JS, Pursley JR, Garverick HA, Fricke PM, Kesler DJ, Ottobre JS, Wiltbank MC. Treatment of cycling and noncycling lactating dairy cows with progesterone during Ovsynch. J Dairy Sci 2006; 89: 2567-2578.
Sudweeks, E. M., R. D. Randel, and M. A. Tomaszewski. 1983. Estrus synchronization after prostaglandin injection in dairy heifers. J. Dairy Sci. 66(Suppl 1):231.
Turner, T. B., G. A. Peterson, M. E. Davis, G. R. Wilson, K. M. Irvin, and J. T. Forry. 1987. Synchronization of estrus in beef cows and heifers with fenprostalene, cloprostenol sodium, and prostaglandin F2 alpha. Theriogenology 28(1):15-24.
USDA. Part I: Reference of Dairy Health and Management in the United States. In. Fort Collins, CO: USDA:APHIS:VS, CEAH; 2002.
Vasconcelos JL, Silcox RW, Rosa GJ, Pursley JR, Wiltbank MC. Synchronization rate, size of the ovulatory follicle, and pregnancy rate after synchronization of ovulation beginning on different days of the estrous cycle in lactating dairy cows. Theriogenology 1999; 52: 1067-1078.
Washburn SP, Silvia WJ, Brown CH, McDaniel BT, McAllister AJ. Trends in reproductive performance in southeastern Holstein and Jersey DHI herds. J Dairy Sci 2002; 85: 244-251.
Wiltbank MC, Shiao TF, Bergfelt DR,and Ginther OJ. 1995. PGF2a receptors in the early bovine corpus luteum. Biol. Reprod. 52: 74-78.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS














