Introdução
A Língua Azul (LA) é uma doença viral infecciosa, não contagiosa dos ruminantes, camelídeos e ocasionalmente, dos cães, cujos insetos transmissores são conhecidos como "mosquito pólvora" ou maruins. As manifestações da doença vão desde inaparente até fatal, dependendo do tipo de vírus envolvido, da espécie, da raça e idade do animal acometido. A língua azul normalmente ocorre quando espécies sensíveis são introduzidas em áreas com circulação viral ou quando o vírus é introduzido nas populações de ruminantes não expostas anteriormente. As perdas mundiais econômicas devido à LA não foram expressas em números exatos, mas a estimativa é de três bilhões de dólares por ano nos Estados Unidos. As perdas são tanto diretas (óbitos, abortamento, perda de peso, produção de leite reduzida e queda na eficiência da produção de carne) quanto, o mais importante, indiretas, como resultado das restrições à exportação de animais vivos, sêmen e hemoderivados.
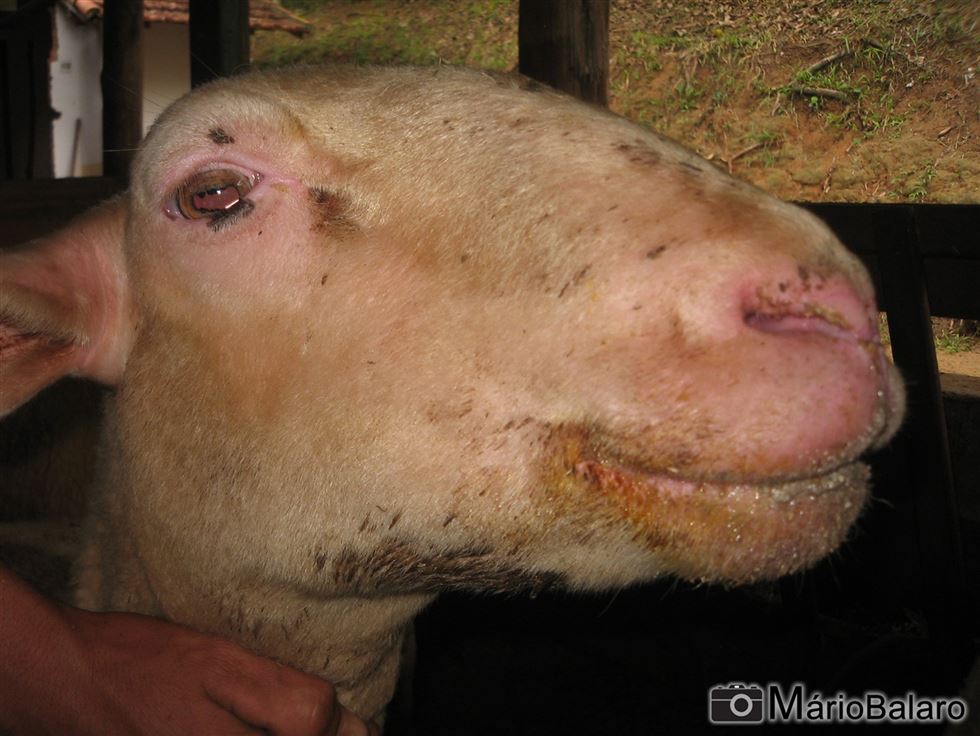
Figura 1 - Ovino apresentando inchaço e vermelhidão de face
História da doença no Brasil
O Brasil e Argentina são os únicos países na América do Sul onde o vírus da Língua Azul (VLA) foi isolado. Ao contrário do ar exótico da doença, ao ouvido de muitos, diversos estudos vêm demonstrando a presença de anticorpos contra o VLA em rebanhos bovinos, caprinos e ovinos ao redor do país. O primeiro caso de isolamento do VLA foi em bovinos zebu, em quarentena na Flórida (EUA), importados do Brasil em 1980. Posteriormente, em 2001, o Panaftosa isolou o vírus a partir do surto em ovinos e caprinos no Paraná. Mais recente, em 2009, o Rio Grande do Sul, relatou um surto em ovinos. O último surto relatado ocorreu há quatro meses numa propriedade de ovinos no Rio de Janeiro.
Bem, ao pensarmos que a base do gado zebuíno veio da Índia que já lida com a doença há mais de 50 anos; associado a falta de exames na importação de animais e sêmen, podemos imaginar a disseminação desse vírus e o seu reposicionamento como endêmico em diversas regiões do Brasil.
Figura 2 - Ovino apresentando inchaço submandibular. Bem similar ao observado em casos de verminose
Epidemiologia
A doença não é incriminada como zoonose, até o momento. A espécie ovina é a mais susceptível de desenvolver o quadro clínico, quando comparado aos outros ruminantes. Dentre os ovinos, algumas raças europeias especializadas para lã fina e corte são mais susceptíveis do que raças tropicais a subtropicais, como a Santa Inês e Morada Nova, por exemplo.
A doença não é contagiosa e muito pouco vírus é encontrado em secreções e excreções de animais infectados como aerossóis, tecidos de órgãos, carcaças e produtos (leite, carne e lã). Deste modo, eles não possuem importância como fonte de transmissão, assim como equipamentos ou pessoas. Como o vírus não sobrevive fora do vetor e hospedeiro, procedimentos de descontaminação ambiental, teoricamente, não são necessários.
A principal forma de transmissão da doença, entre os animais, ocorre por meio dos mosquitos pólvora (dípteros do gênero Culicoides). O mosquito se contamina com o vírus ao picar animais infectados e tem condições de transmitir a doença pelo resto da vida (até 90 dias). As fêmeas colocam seus ovos em zonas com bastante umidade e matéria orgânica como barro, charques, fezes de animais, restos vegetais, etc. Os novos mosquitos podem, dependendo das condições ambientais, surgir em torno de 15 dias com clima propício contra até 7 meses em ambientes desfavoráveis.
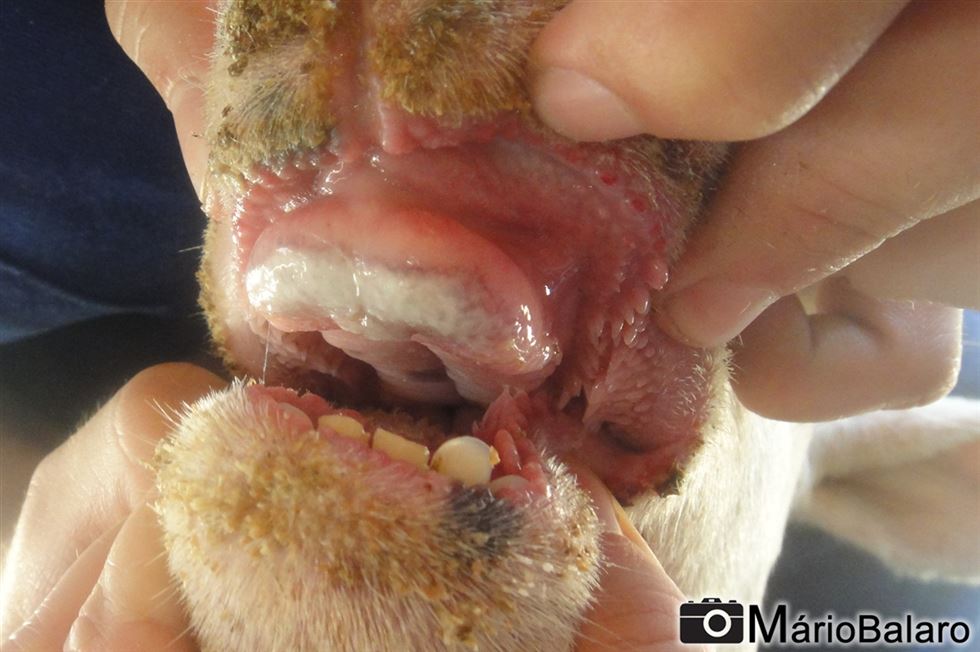
Figura 3 - Infecção oportunista na boca.
Agulhas contaminadas e agentes biológicos como piolhos, carrapatos e moscas podem atuar como vetores mecânicos do vírus. A transmissão intrauterina (mãe-prole), por feridas na pele, colostro e placenta contaminada também é descrita. No âmbito reprodutivo, o sêmen fresco ou congelado e os oócitos e embriões também possuem potencial para infecção caso o reprodutor ou matriz sejam coletados no momento em que estiverem com o vírus na circulação sanguínea.
Sinais clínicos da doença
Após a picada do mosquito e infecção pelo vírus, o ovino começa a apresentar sinais clínicos cerca de 7 dias. O primeiro sinal clínico é a febre que, no início, pode chegar até 41-42ºC, permanecendo em estado febril por cerca de 4 a 8 dias. Concomitantemente, nos casos leves, podem surgir sinais de: vermelhidão de mucosa da boca e narina, lacrimejamento, secreção nasal, salivação, inchaço e petéquias de face, língua e lábios. Nos casos moderados, os sinais evoluem para escoriações e erosões de lábios e boca, hemorragias e lesões oportunistas bacterianas gerando o hálito fétido. O inchaço intenso de língua e cianose também podem ser encontrados nesta fase (o qual fornece o nome da doença, língua azul).
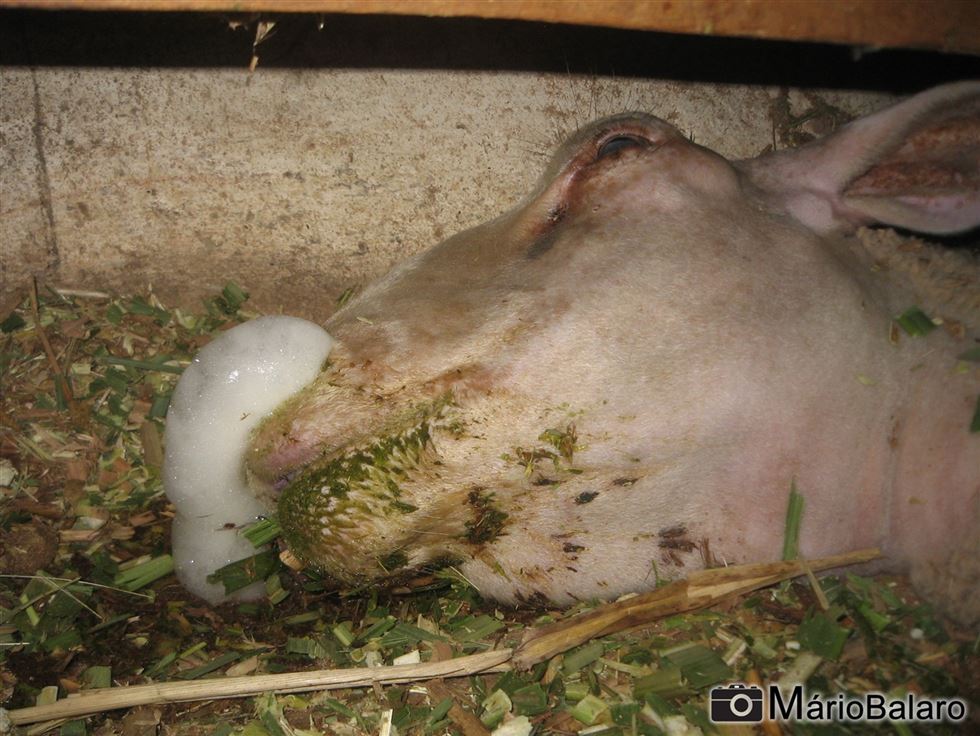
Figura 4 - Morte devido ao edema pulmonar com grande quantidade de espuma saindo das narinas
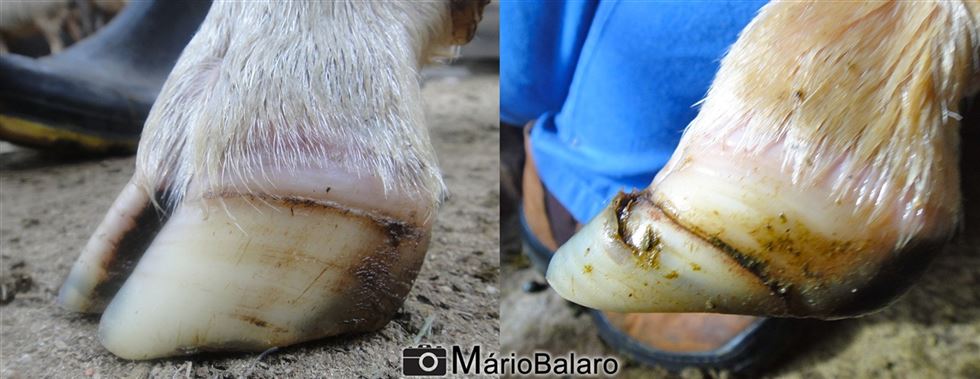
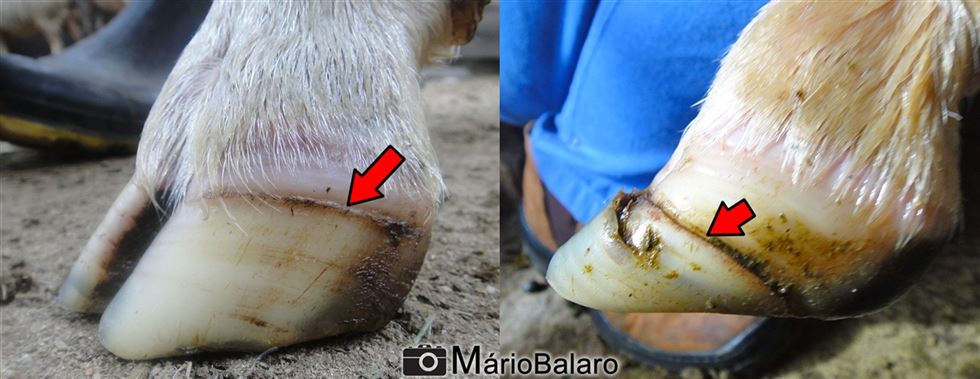
Nos casos graves, o animal perde o apetite e tem parada ruminal com diarreia sanguinolenta, fraqueza progressiva e óbito. Em casos superagudos, geralmente fatais, ocorre intenso acúmulo de líquido no pulmão com presença de espuma saindo das narinas e o animal vem a óbito. Após o período febril, surgem os sinais no sistema locomotor, onde aparece vermelhidão na banda coronária do casco e inflamação posterior, que leva a manqueira e arqueamento do animal. Nesta etapa ainda podem ocorrer lesões musculares que, se localizadas no músculo do pescoço, podem gerar torcicolo. Quando o processo crônifica, a morte pode ocorrer devido a pneumonia secundária bacteriana e exaustão. Ao suspeitar que a doença já atingiu o rebanho, um bom sinal que o produtor pode procurar esta presente nos cascos dos animais. Como o vírus agride a região inicial de formação do casco (banda coronária), até 4-5 meses após a infecção, pode-se detectar uma linha escura paralela às linhas de crescimento do casco. E esta, possui uma relação cronológica com a presença do vírus no animal. Quanto mais distante da interseção pele/casco e proximidade das pinças, mais meses se passaram desde o contato com o agente infeccioso.
Em carneiros, pode ocorrer a inflamação e hemorragias pontiformes da bolsa escrotal, assim como a inflamação do epidídimo e degeneração dos testículos. A queda na fertilidade, nos reprodutores, pode ser perceptível por até 90 dias. A infecção em ovelhas gestantes pode levar ao abortamento, mumificação fetal e o nascimento de cordeiros fracos com potenciais defeitos congênitos como hidrocefalia, cistos cerebrais, displasia da retina.
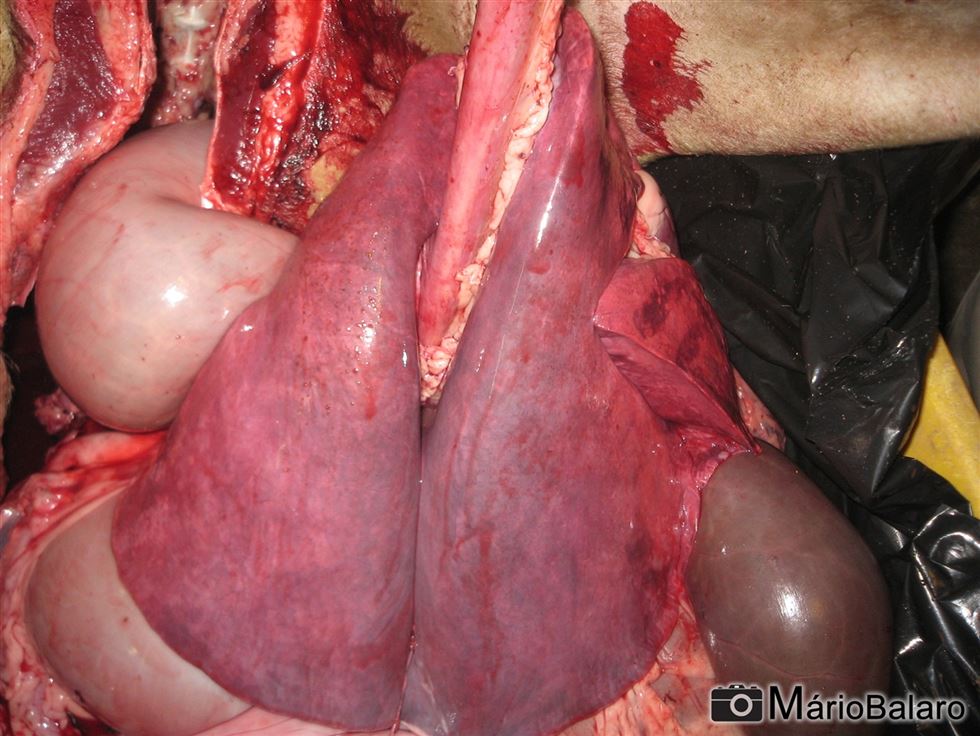
Figura 5 - Pulmão de ovino que veio a óbito
De um ponto de vista econômico, além da perda de lã, as lesões da musculatura são provavelmente as mais importantes alterações causadas pela Língua Azul, uma vez que estão normalmente associados com a perda bruta de condição corporal, fraqueza, lentidão e um período de recuperação prolongado.
Os sinais clínicos em bovinos são raros e geralmente estão limitados a uma resposta febril transitória, aumento da frequência respiratória, lacrimejamento e salivação aumentada, rigidez e alterações inflamatórias na pele. Alterações reprodutivas como abortamentos e nascimento de filhotes com hidroencefalia também é relatado. Os caprinos são considerados resistentes à doença, e quando os sinais clínicos ocorrem, os mesmos são semelhantes aos apresentados por ovinos, incluindo abortamento, parto prematuro, cabritos fracos e quebra no leite. Entretanto, a fase de convalescença prolongada devido a fraqueza secundária por lesões musculares ainda não foi descrita.
Na necropsia são evidenciadas alterações ao longo do trato digestivo, respiratório e linfático como hemorragias, petéquias e erosões devido a ação do vírus sobre o sistema circulatório. A hemorragia encontrada na base da artéria pulmonar, muitas vezes, é considerada como sinal característico da doença. Na musculatura esquelética pode ser detectada necrose e degeneração de fibras musculares (principalmente região do pescoço).
Figura 6 - Fezes moles com presença de estrias de sangue
Figuras 7 e 7.1 - Linha no casco, marca a inflamação antiga na região coronária. Detalhe para o descolamento da porção final do tecido córneo na imagem à direita
Diagnóstico
A Língua Azul faz parte da lista de doenças vesiculares do Ministério de Agricultura e, sob suspeita clínica, deve ser notificada para o Órgão de Defesa Animal do município, caso contrário o médico veterinário é passível de advertência. Deve ser feito o diagnóstico diferencial para dermatite pustular infecciosa, varíola ovina, hemoncose aguda, salmonelose, fotossensibilidade hepatogênica (plantas tóxicas e micotoxinas), poliartrite, aftosa, ectima contagioso, peste dos ruminantes, pneumonia, distrofia muscular nutricional (DMN) associada à deficiência de selênio e vitamina E.
A nossa experiência profissional com a língua azul têm demonstrado a semelhança dos sinais clínicos da doença principalmente com a verminose, planta tóxica (ex. coerana/Cestrum sp.) e pneumonia. Ou seja, doenças comumente relatadas no campo. Deste modo, acreditamos que a língua azul seja subdiagnosticada.
O diagnóstico laboratorial é realizado pela detecção de: (1) anticorpos específicos contra o vírus, (2) detecção de partículas do vírus e (3) isolamento do vírus. Os exames sorológicos podem detectar a exposição anterior ao VLA, mas não conseguem estabelecer se o animal encontra-se em estado recente com o vírus no sangue. Informação esta, importante na tomada de decisões para o trânsito animal.
Para identificação e isolamento viral no período de viremia (vírus no sangue), deve-se coletar amostra de sangue total (tubo de tampa roxa com EDTA ou tubo de tampa verde com heparina) para análise. No caso do óbito e realização da necropsia, deve-se coletar fragmentos de baço, pulmão, tonsilas e linfonodos pré-escapular, mesentéricos, poplíteos e ilíacos. Se o animal vier a óbito após o período de viremia, os órgãos de eleição para coleta são o baço e linfonodos citados anteriormente.
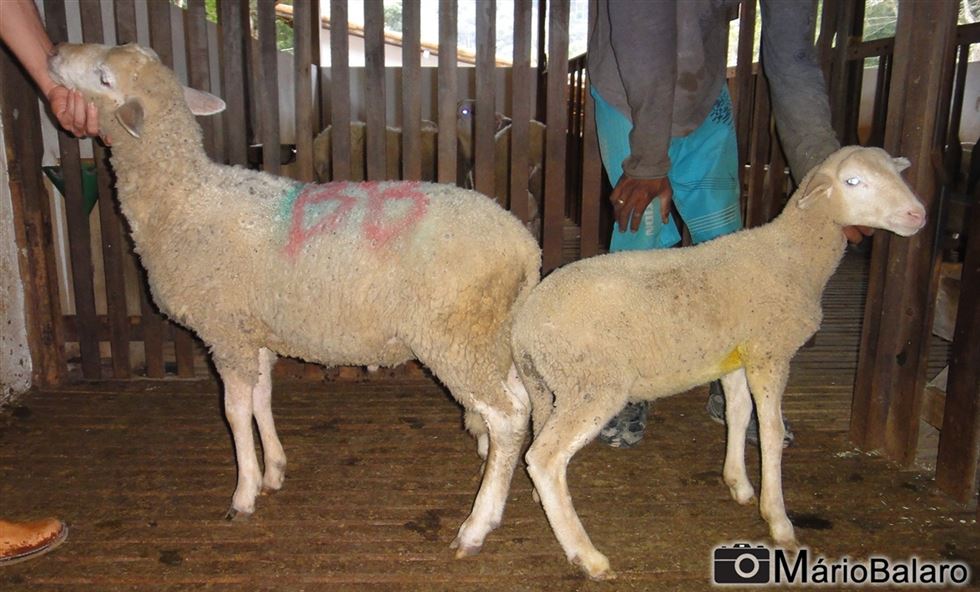
Figura 8 - Prejuízo no desenvolvimento ponderal de cordeiros. Animal à direita afetado pela Língua Azul.
Tratamento
Não existem tratamentos específicos. Nos animais doentes com lesões pulmonares, pode ser adotado o uso de antibióticos visando a prevenção de infecções bacterianas secundárias. Os animais afetados devem ser retirados da exposição direta ao sol, pois a mesma agrava as lesões de pele no quadro clínico. Os mesmos também devem ser isolados dos demais e serem tratados com repelentes para se evitar a picada de mosquitos. Deve ser ofertado capim ou feno de boa qualidade, água e sal mineral à vontade. Como complementar na terapia pode ser utilizada vitamina ADE injetável, sulfato de Cobalto ou Cloreto de Cobalto associado à Vitamina B12 e o Sulfato de zinco. No caso de animais muito debilitados, sem apetite e parada ruminal persistente, pode ser preconizado a transferência de suco de rúmen para tal.
Controle
A Língua azul é uma doença de notificação obrigatória para a Organização Internacional de Sanidade Animal – OIE, e deve ser realizada em até 24 horas após diagnóstico da doença. O controle deve ser baseado em ações integradas envolvendo o vetor, o hospedeiro e o ambiente.
Com relação ao vetor, mosquito-pólvora, sua erradicação é muito difícil. Assim, medidas como evitar pastagens úmidas baixas, confinar os animais no final da tarde até o início da manhã (atividade crepuscular e noturna do mosquito), realizar a tosquila no início do verão para os animais já terem um pouco de lã no final do verão (quando geralmente aparece a doença) e uso de repelentes são indicados. Inseticidas e larvicidas, sob autorização, também podem ser utilizados na propriedade. A aplicação de cal, embaixo do aprisco e no local onde ficam as fezes acumuladas na propriedade, também é importante para diminuir o número de novos mosquitos no ambiente.
Para controle no hospedeiro deve-se ter em mente: (1) a importância do bovino na manutenção e propagação do agente viral devido ao maior período com o vírus viável no sangue; (2) quarentena e controle do trânsito de ruminantes em zona infectada; (3) inquérito sorológico na região de risco e acompanhamento dos animais nascidos com relação a quadros clínicos ou soroconversão; (4) cuidado no uso de biotecnologias da reprodução, ou seja, utilizar sêmen de animais saudáveis e empresas idôneas. Ao se trabalhar com Transferência de embriões, deve-se agir de acordo com as normas da Associação Internacional de tecnologia de embriões - IETS; (5) consciência das formas de transmissão por via transplacentária e ingestão de colostro e placenta contaminada; (6) acompanhando da infecção dos cordeiros, após queda de anticorpos do colostro, e outras matrizes negativas em lotes comunitários; (7) uso de agulhas descartáveis e no caso de reutilização de materiais perfuro cortantes realizar a correta limpeza e desinfecção prévia; (8) a vacinação é uma excelente ferramenta de controle em regiões endêmicas, e é o carro chefe no controle da doença. Os cordeiros recebem a imunidade adquirida através do colostro que dura até cerca de três meses, desta forma, é importante a vacinação após este período; (9) não há justificativa de abate dos animais infectados ou expostos. O sacrifício apenas deve ser preconizado por questões de bem-estar animal comprometida.
Para controle ambiental, é necessário evitar ou drenar aguadas, assim como evitar áreas ricas em matéria orgânica; destinar as fezes para esterqueiras; plantio de repelentes naturais, como a citronela, ao redor das instalações dos animais e evitar correntes de vento extensas na propriedade utilizando-se de quebra-ventos naturais como árvores e arbustos.
Considerações finais
A presente revisão objetivou alertar os produtores, técnicos e médicos veterinários no campo e os órgãos de defesa animal para a elaboração e divulgação de material técnico-educativo relativo a doença, a fim de esclarecer os sintomas, diagnóstico e gravidade da mesma. Em associação, deve-se ter em mente a necessidade de um programa de vigilância entomológica e sorológica permanente associado a um efetivo plano de contingência para a doença, particularmente à luz das recentes mudanças na distribuição global, natureza da infecção e impacto na produção animal causado pelo vírus da língua azul.
Literatura consultada
ANTONIASSI, N.A.B.; PAVARINI, S.P.; RIBEIRO, L.A.O.; SILVA, M.S.; FLORES, E.F.; DRIEMEIER, D. Alterações clínicas e patológicas em ovinos infectados naturalmente pelo vírus da língua azul no Rio Grande do Sul. Pesquisa Veterinária Brasileira, v.30(12):1010-1016, dez 2010.
BOUWKNEGT, C.; VAN RIJN, P.A.; SCHIPPER, J.J.M.; LZEL, D.H.; BOONSTRA, J; NIJHOF , A.M. • ROOIJ, E.M.A.; JONGEJAN, F. Potential role of ticks as vectors of bluetongue virus. Exp Appl Acarol, v.52: 183-192, 2010.
BÜRSTEL, D.; ADAMS, W.; GANTER, M. Evaluation of the reproductive performance in rams following recovery of Bluetongue disease. Tierärztl. Prax, v.37(G): 289–295, 2009.
CLAVIJO, A.; SEPULVEDA, L.; RIVA, J.; PESSOA-SILVA, M.; TAILOR-RUTHES, A.; LOPEZ, J.W. Isolation of bluetongue virus serotype 12 from an outbreak of the disease in South America. Veterinary Record, v.151(10): 301-302, 2002.
GROOCOCK, C.M.; CAMPBELL, C.H. Isolation of an exotic serotype of bluetongue virus from imported cattle in quarantine. Can. J. Comp. Med., v.46: 160-164, 1982.
LAGER, I.A. Bluetongue virus in South America: overview of viruses, vectors, surveillance and unique features.Vet. Ital., v.40(3): 89-93, 2004.
KIRKLAND, P.D.; MELVILLE, L.F.; HUNT, N.T.; WILLIAMS, C.F.; DAVIS, R.J. Excretion of bluetongue virus in cattle semen: a feature of laboratory-adapted virus.Vet. Ital., v.40 (4):497-501, 2004.
MACLACHLAN, N.J.; DREW, C.P.; DARPEL, K.E.; WORWA, G. The pathology and pathogenesis of bluetongue. J. Comp. Pathol. v.141:1-16, 2009.
MELLOR, P. S.; BOORMAN, J.; BAYLIS, M. Culicoides Biting Midges: Their Role as Arbovirus Vectors. Annu. Rev. Entomol. v.45: 307-340, 2000.
MENZIES, F. D.; MCCULLOUGH, S. J.; MCKEOWN, I. M.; FORSTER, J. L.; JESS, S.; BATTEN, C.; MURCHIE, A. K.; GLOSTER, J.; FALLOWS, J. G.; PELGRIM, W.; MELLOR, P. S.; OURA, C. A. L. Evidence for transplacental and contact transmission of bluetongue virus in cattle. Veterinary Record, v.163: 203-209, 2008.
OIE. World Organisation for Animal Health .Manual of diagnostic tests and vaccines for terrestrial animals. 2008. Chapter 2.1. 9. Bluetongue virus. Disponível em: <https:// https://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.01.03_BLUETONGUE.pdf>. Acesso em março de 2013.
RADOSTITS, O.M.; GAY, C.C.; HINCHCLIFF, K.W.; CONSTABLE, P.D. Veterinary Medicine. A textbook of the diseases of cattle, horse, sheep, pigs and goats. 10th Ed. Saunders Elsevier, Philadelphia, 2007, p.1691-1783.
VANDENBUSSCHE, F. ZIMMER, J.Y.; HAUBRUGE, E.; CASSART, D.; CLERCQ, K.; KIRSCHVINK, N.The impact of naturally-occurring, trans-placental bluetongue virus serotype-8 infection on reproductive performance in sheep. The Veterinary Journal, v.187: 72–80, 2011.
SCOLARI, A.P.R.; AYUB, B.R.; SOTOMAIOR, C.S., OLLHOFF, R.D. O vírus da língua azul em ruminantes domésticos: situação de alerta no Brasil – Revisão. Rev. Acad., Ciênc. Agrár. Ambient. Curitiba, v. 9(4): 407-413, 2011.
VERWOERD, D.W.; ERASMUS, B.J. Bluetongue, p.1201-1220. In: Coetzer J.A.W. & Tustin R.C. (Eds), Infectious Disease of Livestock. Vol.2. 2nd ed. Oxford Univertsity Press, Cape Town. 2004.
WILBUR, L.A.; EVERMANN, J.F.; MERTENS, P.P. et al. Abortion and death in pregnant bitches associated with a canine vaccine contaminated with bluetongue virus. J. Am. Vet. Med. Assoc., v.204:1762-65, 1994.
WORWA, G.; HILBE, M.; CHAIGNAT, V.; HOFMANN, M.A.; GRIOT, C.; EHRENSPERGER, F.; DOHERR, M.G.; THU, B. Virological and pathological findings in Bluetongue virus serotype 8 infected sheep. Veterinary Microbiology, v.144: 264–273, 2010.
Dados inválidos!
Verifique suas credenciais e tente novamente: atente-se aos caracteres em
maiúsculo e minúsculo.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
Acesso a matérias, novidades por newsletter, interação com as notícias e muito mais.
ENTRAR SOU UM NOVO USUÁRIO