Não houve grande melhora em taxa de concepção com IATF (Santos et al., 2009), embora os protocolos mais recentes de sincronização que incluem uma pré-sincronização intensiva (Double-ovsynch; Souza et al., 2008) e duplas injeções de PG antes da IA para garantir luteólise completa (Wiltbank et al., 2015) podem chegar a 50% de taxa de concepção ao primeiro serviço pós-parto.
Existem inúmeros sistemas no mercado, mas é necessário avaliar melhor os sistemas de MAA (detectores eletrônicos de monta e monitores automáticos de atividade). Alguns sistemas dispõem de recursos como limiares ajustáveis por fazenda leiteira ou por grupos de vacas, mas estes não parecem estar sendo utilizados extensivamente. Por exemplo, ajustes poderiam ser feitos de acordo com a estação do ano ou nível de produção de leite. Além disso, a possibilidade de ajustes agrega complexidade aos sensores e exige uma curva de aprendizado para seu uso adequado. Mesmo o MAA mais simples provavelmente exige tempo e paciência para que os funcionários aprendam a usá-lo e se familiarize com o software dos sensores.
Detecção de estro e monitores de atividade
Sistemas automatizados usam parâmetros variados (contagem de passos, aceleração de movimento, tempo/frequência de ruminação, tempo de descanso/atividade) para análise dos resultados. Alguns exemplos são o ALPRO (DeLaval; Suécia), SmartDairy Activity (Boumatic, EUA), AfiTag (Afimilk, Israel), VacaAlert (IceRobotics, Inglaterra) e HR Tag (SCR Engineers, Israel).
Estes MAAs são comprovadamente eficientes na detecção de estro. Usando o Heatime, Valenza et al. (2012) detectaram 71% das fases pré-ovulatórias, mas deixaram de identificar 13% das ovulações. Com o mesmo sensor, Aungier et al. (2012) identificaram corretamente 72% das fases pré-ovulatórias, mas tiveram 32% de falso-positivos. É possível que alguns destes falso-positivos não ocorreram, pois o ponto de corte usado para determinar altos níveis de progesterona (estro falso-positivo) era extremamente baixo (progesterona >0,6 ng/mL). Sabe-se que progesterona no leite de 3 ng/mL ou mais indica presença de um CL ativo. Além disso, um estudo da Dinamarca (Løvendahl e Chagunda, 2010) usou sensores de atividade e obteve 74,6% de taxa de detecção e 1,3% de taxa diária de erro ao usar o algoritmo mais eficiente calculado pelos autores. O estudo demonstra o grande potencial desta tecnologia para resolver o problema da detecção de estro em rebanhos leiteiros comerciais.
A ruminação é outro parâmetro que pode ser usado para detecção automatizada do estro. Variações em comportamento alimentar, alinhadas à maior atividade física e inquietação típicas do estro, resultam em menor tempo de ruminação durante o estro. Pahl et al. (2015) demonstraram redução do período de alimentação e ruminação nos dias -1 e 0 em relação à IA. A redução do tempo gasto em cada visita ao cocho poderia ser outro indicador de inquietação.
Poucas pesquisas foram conduzidas sobre a avaliação de descanso e movimentação para detecção de estro. Rutten et al. (2013) revisaram 48 trabalhos, mas somente dois traziam informações sobre estes parâmetros (de Mol et al., 2009; Brehme et al., 2008). Recentemente, nosso grupo analisou informações de descanso e atividade em relação ao período estral em maiores detalhes (Silper et al., 2015b; Silper et al., 2015d). Resultados destes estudos indicam grande potencial de melhora da precisão de detecção do estro, assim como uso de informações quantitativas (como variação proporcional de comportamento de descanso no dia do estro em relação ao dia anterior e posterior) dos monitores para auxiliar na tomada de decisão quanto à IA.
Somente um trabalho mais antigo (Brehme et al., 2008) descreveu a ausência de descanso por longo período (16 horas) durante o estro. Entretanto, este trabalho não fornece informações detalhadas sobre medidas ou fatores que afetam o tempo de repouso. Um sistema MAA (AfiTag, Afimilk) usa número de passos, tempo de repouso e um índice de inquietação no algoritmo de detecção de estro, mas existem poucos trabalhos na literatura avaliando sua eficiência e medidas de expressão de estro.
Dada a grande variabilidade dos relatos e baixo nível de expressão do estro em geral, parece que a combinação de vários parâmetros em um mesmo sistema é potencialmente uma alternativa para a redução de falso-negativos. A combinação de atividade e repouso do IceTags (IceRobotics) reduziu significativamente a taxa de erro (falsos alertas) e aumentou a probabilidade da detecção do estro (Jónsson et al., 2011). Peralta et al. (2005) também sugerem que combinações de sistemas são a melhor alternativa para melhorar detecção e taxa de concepção durante períodos de estresse calórico. O uso de mais de uma medida em um mesmo sensor pode aumentar a especificidade e reduzir os falso-positivos (Firk et al., 2002).
Expressão do estro e a fertilidade: programas reprodutivos
Um levantamento de rebanhos leiteiros canadenses demonstrou que programas baseados em detecção de estro através de MAA resultam em desempenho reprodutivo semelhante ao de programas de IATF (Neves e LeBlanc, 2015; Denis-Robichaud et al., 2015). Poucos estudos, normalmente grandes levantamentos, avaliaram o cenário dos programas reprodutivos na América do Norte.
Caraviello et al. (2006) demonstram que mais de 50% das fazendas leiteiras utilizam programas de IATF. No Canadá, um recente levantamento indicou amplo uso de programas de IATF, mas a detecção visual ainda é o sistema mais utilizado pelos produtores (Denis-Robichaud 2015). Este número, entretanto, varia muito entre regiões. Por exemplo, na área de Quebec, que concentra um grande número de fazendas leiteiras de sistema tie-stall com pequeno número de vacas, tende a usar menos os programas reprodutivos e outras tecnologias.
No levantamento (Denis-Robichaud et al., 2015), relatamos o resultado de 772 entrevistas, que representam 6% do número total de fazendas leiteiras do Canadá. O rebanho médio tinha 84 vacas em lactação (mediana = 60; variação interquartil = 40-95 vacas/rebanho) e representativo de todas as províncias canadenses. As vacas em lactação eram alojadas em tie-stall (55%) e free-stall (45%). Sistemas MAA eram usados em 28% das fazendas participantes (4% dos rebanhos em tie-stall, mas 59% dos rebanhos em free-stall) e eram consultados pelo menos 2x ao dia para alertas de alta atividade por quase todos os usuários (92%). Interessante que 21% dos participantes jamais confirmavam cio por observação visual antes da inseminação, enquanto 26% sempre o faziam. Os resultados deste levantamento ressaltam a variabilidade de manejo reprodutivo em rebanhos leiteiros no Canadá e este conhecimento deve ajudar a otimizar o desenvolvimento e implementação de ferramentas de manejo reprodutivo.
Os programas reprodutivos com amplo uso de protocolos de IATF ainda são o padrão ouro em relação a melhoras em taxas de prenhez. Recentes ensaios de campo compararam diferentes “graus” de combinação IATF e IA após detecção de estro usando MAA. O risco de concepção (30% vs. 31%) e dias até prenhez (137 e 122 dias) foram semelhantes entre vacas inseminadas após IATF ou detecção de estro por Heatime (Neves et al., 2012). Outros estudos recentes usaram diferentes combinações entre MAA e programas de IATF (Valenza et al., 2012; Stevenson et al., 2014; Fricke et al., 2014; Burnett et al., 2014) e os resultados indicam que é possível obter taxas de prenhez semelhantes em programas mais intensivos de detecção de estro.
Este conjunto de grandes ensaios de campo procuram modificar vários fatores que afetam a resposta ao programa reprodutivo, principalmente na primeira IA. Por exemplo, o período voluntário de espera variou entre 50 e 100 DEL, dependendo do tratamento e foram testados protocolos de pré-sincronização que focam em indução de estro (baseados em PG) ou ciclicidade e sincronização de ovulação (baseados em GnRH). Todos os estudos demonstraram que a combinação de métodos (IATF e MAA) talvez seja a melhor opção, uma vez que permite altas taxas de concepção e inseminação de grande número de vacas. Neste caso, protocolos de IATF ainda são necessários como salvaguarda para um certo número de vacas que não seriam inseminadas até 100 DEL. A questão do quando intervir com protocolos de IATF é provavelmente uma área que poderia ser melhor estudada em pesquisas futuras. É bem provável que a adoção de sistemas MAA como parte de grandes programas reprodutivos vai variar muito entre fazendas.
Os trabalhos de Neves et al. (2012) e Burnett et al. (2014) demonstraram grande variação no grau de adoção de IATF e IA baseada em alertas MAA. Outra vantagem da combinação de IATF e MAA é provavelmente a redução do uso de intervenções farmacológicas. Entretanto, ainda está para ser demonstrado como estes programas se comportariam em áreas de estresse calórico intenso, uma vez que a temperatura tende a exercer grande impacto sobre a detecção da manifestação e da intensidade do estro.
Expressão do estro e fertilidade: manifestação e intensidade peri-IA
No corrente estudo, foram avaliados fatores de risco relacionados à intensidade do pico e duração dos eventos do estro. Ainda que as novas tecnologias capturem a atividade física usando sensores e algoritmos de processamento de dados que são significativamente diferentes dos usados no passado recente, foi interessante observar a falta ou a correlação relativamente fraca entre medidas de expressão do estro, produção de leite e diâmetro do folículo pré-ovulatório.
Em uma série de estudos recentes usando diferentes sistemas MAA, diferentes fazendas, épocas variadas de estudo e localização geográfica distinta, ficou claro que houve melhora substancial na taxa de P/IA a partir de identificação de eventos de estro e alta atividade (Madureira et al., 2015a; Madureira et al., 2015b; Burnett et al., 2014) e significativa redução em períodos de repouso no dia do estro (Silper et al., 2015d).
Melhor fertilidade era esperada em vacas com maior intensidade de expressão do estro, mas a associação mais comum foi com melhora de ECC, menor rendimento leiteiro, vacas primíparas e sanidade. Na verdade, observamos maior intensidade e duração à medida que o ECC aumentou, assim como em novilhas, mas houve melhora da taxa de P/IA apesar dos fatores de risco que comprovadamente afetam a taxa de concepção. É possível que as informações já disponíveis em softwares de manejo usados em fazendas leiteiras comerciais possam ser usadas para calibrar dispositivos de MAA para que sejam consideradas condições fenotípicas da vaca. O uso de medidas de intensidade e duração de pico poderiam auxiliar na previsão da fertilidade e na tomada de decisões referentes a programas reprodutivos a partir de programas de monitoramento de atividade. Além disso, existe potencial de uso de sistemas MAA como ferramenta objetiva e precisa para selecionar animais de melhor expressão de estro, mas este tópico requer pesquisas complementares.
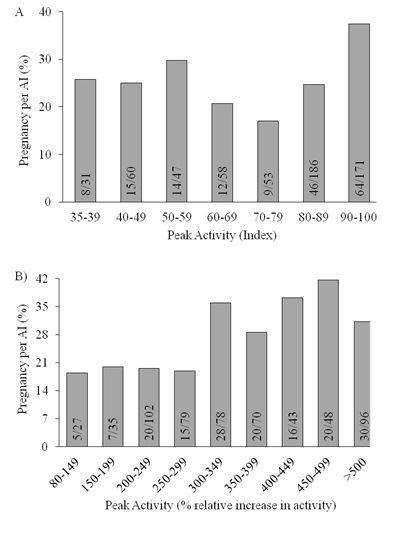
Vacas com alta intensidade de pico apresentaram 12 a 14% de maior P/IA que vacas com menor pico, o que representa um aumento de 35% na fertilidade (Madureira et al., 2015a; Madureira et al., 2015b). Anteriormente, Lopez-Gatius et al. (2005) relataram melhora de 1,001-vezes para cada unidade de aumento relativo no número de passos.
Já foi mencionado que o diâmetro do folículo pré-ovulatório não variou entre as categorias de diferente intensidade de pico, mas isto não quer dizer que a duração do pró-estro ou de dominância tenha sido semelhante, uma vez que não houve controle de emergência folicular nos estudos recentes. Desta forma, duração de proestro e dominância (Bleach et al., 2004; Cerri et al., 2009) não podem ser descartadas como possíveis causas de redução da fertilidade.
Outro possível fator que influencia P/IA é a taxa de ovulação de vacas com diferente intensidade de pico no estro. Madureira et al. (2015b) observaram maior falha de ovulação em vacas que demonstraram estro com aumento relativo em intensidade de pico de 80 a 100%, o menor aumento relativo possível depois de ultrapassar o limiar do MAA usado. Embora esta observação seja importante para explicar nossos resultados, está limitada a vacas que expressam baixa intensidade de pico durante o estro, uma vez que o limiar entre intensidade de pico alta e baixa era de mais de 300% de aumento relativo no corrente estudo. É importante observar que um dos estudos mencionados usou ECP para induzir estro e ovulação, elevando os níveis de estradiol circulante até patamares bastante elevados. Apesar disto, a intensidade de pico medida por pedômetro ainda afetou significativamente os resultados de P/IA (Madureira et al., 2015b).
A manifestação do estro peri-IA (Pereira et al., 2014) foi associada à redução em perdas gestacionais. Além disso, Pereira et al. (2015) também relataram que animais que demonstram estro na IA apresentavam menor taxa de perda gestacional, independentemente do diâmetro do folículo pré-ovulatório. O estudo de Pereira et al. (2015) foi um grande ensaio de campo e um dos primeiros estudos a descrever o imenso impacto da expressão do estro sobre a redução de perdas gestacionais. Além disso, este estudo demonstrou que este efeito se aplica tanto a programas baseados em IA quanto em transferência de embriões, indicando uma possível modificação do ambiente uterino como explicação da melhor fertilidade com manifestação de estro. Este resultado prático de Pereira et al. (2015) corrobora nossos dados obtidos em vacas de corte, que demonstraram extensa modulação da expressão gênica de transcritos-chave relacionados ao sistema imune e moléculas de adesão (Davoodi et al., 2016). De maneira geral, parece que a expressão do estro tem importantes efeitos positivos sobre a manutenção da gestação (redução de perdas gestacionais 32 e 60 dias de gestação).
Em um estudo conduzido por Bisinotto et al. (2015), os autores modificaram as concentrações de progesterona durante o crescimento do folículo pré-ovulatório, comparando a primeira e a segunda onda folicular. Importantes resultados descreveram a importância e como a progesterona exógena (2 dispositivos intravaginais) “resgata” o folículo pré-ovulatório da primeira onda folicular e resulta em excelente fertilidade. Um achado interessante deste estudo relacionado ao estro é que as vacas que ovularam folículos da primeira onda folicular em baixas concentrações plasmáticas de progesterona (pior cenário possível do estudo), mas que expressaram estro na IA, apresentaram taxa de concepção e prenhez/IA semelhantes às vacas de outros tratamentos.
Uma possível explicação para correlacionar a intensidade do estro e P/IA, que ainda não foi amplamente estudada, é que vacas poderiam ter variação individual maior que a esperada de expressão de receptores de estrógeno no endométrio e, talvez mais importante, no hipotálamo. O resultado é que algumas vacas seriam mais capazes de traduzir as concentrações circulantes de estradiol em comportamentos relacionados ao estro e em um ambiente uterino mais favorável ao desenvolvimento embrionário.
Figura 1. Correlação entre produção de leite no dia da IA.
A) pico de atividade (valor índice) medido por sensor em coleira (r = 0,20, P < 0,01), e B) porcentagem de aumento relativo de atividade medido por sensor tipo pedômetro (r = 0,05, P < 0,01).
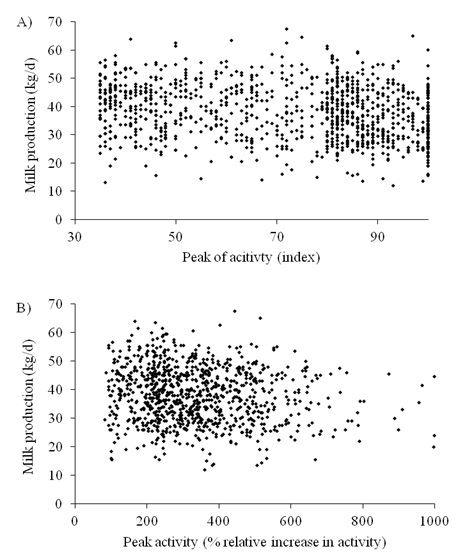
Figura 2. Distribuição de prenhez por IA (%) de acordo com atividade de pico durante o estro detectada por:
A) sensor em coleira e B) sensor em pedômetro.
Parâmetros produtivos e reprodutivos associados ao comportamento de estro - Parte 3
Parâmetros produtivos e reprodutivos associados ao comportamento de estro - Parte 2
Parâmetros produtivos e reprodutivos associados ao comportamento de estro - Parte 1
Referências bibliográficas
Albright, J.L., and C.W. Arave. 1997. Reproductive behaviour. Pages 82–89 in The Behaviour of Cattle. CAB International, New York, NY.
Allrich, R.D. 1994. Endocrine and neural control of estrus in dairy cows. J. Dairy Sci. 77:2738–2744. doi:10.3168/jds.S0022-0302(94)77216-7.
Arney, D., S.E. Kitwood, and C.J.C. Phillips. 1994. The increase in activity during oestrus in dairy cows. Appl. Anim. Behav. Sci. 40:211-218.
At-Taras, E.E., and S.L. Spahr. 2001. Detection and characterization of estrus in dairy cattle with an electronic heatmount detector and an electronic activity tag. J. Dairy Sci. 84:792–798. doi:10.3168/jds.S0022-0302(01)74535-3.
Atkins J.A., M.F. Smith, M.D. MacNeil, E.M. Jinks, F.M. Abreu, L.J. Alexander, T.W. Geary. 2013. Pregnancy establishment and maintenance in cattle. J. Anim Sci. 91:722-733. doi: 10.2527/jas.2012-5368.
Aungier, S.P.M., J.F. Roche, P. Duffy, S. Scully, and M.A. Crowe. 2015. The relationship between activity clusters detected by an automatic activity monitor and endocrine changes during the periestrous period in lactating dairy cows. J. Dairy Sci. 98:1666–1684. doi:10.3168/jds.2013-7405.
Aungier, S.P.M., J.F. Roche, M. Sheehy, and M.A. Crowe. 2012. Effects of management and health on the use of activity monitoring for estrus detection in dairy cows. J. Dairy Sci. 95:2452–66. doi:10.3168/jds.2011-4653.
Bello, N.M., J.S. Stevenson, and R.J. Tempelman. 2012. Invited review: milk production and reproductive performance: modern interdisciplinary insights into an enduring axiom. J. Dairy Sci. 95:5461–5475. doi:10.3168/jds.2012-5564.
Bisinotto, R.S., L.O. Castro, M.B. Pansani, C.D. Narciso, N. Martinez, L.D.P. Sinedino, T.L.C. Pinto, N.S. Van de Burgwal, H.M. Bosman, R.S. Surjus, W.W. Thatcher, and J.E.P. Santos. 2015. Progesterone supplementation to lactating dairy cows without a corpus luteum at initiation of the Ovsynch protocol. J. Dairy Sci. 98:2515–2528. doi:10.3168/jds.2014-9058.
Bisinotto, R.S., E.S. Ribeiro, L.T. Martins, R.S. Marsola, L.F. Greco, M.G. Favoreto, C.A. Risco, W.W. Thatcher, and J.E.P. Santos. 2010. Effect of interval between induction of ovulation and artificial insemination (AI) and supplemental progesterone for resynchronization on fertility of dairy cows subjected to a 5-d timed AI program. J. Dairy Sci. 93:5798-5808.
Bleach, E.C.L., R.G. Glencross, and P.G. Knight. 2004. Association between ovarian follicle development and pregnancy rates in dairy cows undergoing spontaneous oestrous cycle. Reprod. 127:621-629.
Bloch, A., Y. Folman, M. Kaim, Z. Roth, R. Braw-Tal, and D. Wolfenson. 2006. Endocrine alterations associated with extended time interval between estrus and ovulation in high-yield dairy cows. J. Dairy Sci. 89:4694–4702. doi:10.3168/jds.S0022-0302(06)72520-6.
Brehme, U., U. Stollberg, R. Holz, and T. Schleusener. 2008. ALT pedometer—New sensor-aided measurement system for improvement in oestrus detection. Comput. Electron. Agric. 62:73–80. doi:10.1016/j.compag.2007.08.014.
Bridges, G.A., L.A. Helser, D.E. Grum, M.L. Mussard, C.L. Gasser, and M.L. Day. 2005 Decreasing the interval between GnRH and PGF2alpha from 7 to 5 days and lengthening proestrus increases timed-AI pregnancy rates in beef cows. Theriogenology 69:843-851.
Britt, J.H., R.G. Scott, J.D. Armstrong, and M.D. Whitacre. 1986. Determinants of Estrous Behavior in Lactating Holstein Cows. J. Dairy Sci. 69:2195–2202. doi:10.3168/jds.S0022-0302(86)80653-1.
Buhi W.C., I.M. Alvarez. 2003. Identification, characterization and localization of three proteins expressed by the porcine oviduct. Theriogenology. 60:225-238.
Burnett, T.A., M.A. Khan, M.A.G. von Keyserlingk, R.L.A. Cerri. 2015. Body weight loss of cows early postpartum has negative effects on estrous expression. J. Dairy Sci. 98(Suppl.1):95.
Burnett, T.A., A.M.L. Madureira, B.F. Silper, A.C.C. Fernandes, and R.L.A. Cerri. 2014. Effect of an automated estrous detection system during a timed artificial insemination program on first postpartum artificial insemination. J. Dairy Sci. 97(Suppl.1):271.
Caraviello, D.Z., K.A. Weigel, P.M. Fricke, M.C. Wiltbank, M.J. Florent, N.B. Cook, K. V Nordlund, N.R. Zwald, and C.L. Rawson. 2006. Survey of management practices on reproductive performance of dairy cattle on large US commercial farms. J. Dairy Sci. 89:4723–4735. doi:10.3168/jds.S0022-0302(06)72522-X.
Cerri, R.L.A., R.C. Chebel, F. Rivera, C.D. Narciso, R.A. Oliveira, M. Amstalden, G.M. Baez-Sandoval, L.J. Oliveira, W.W. Thatcher, and J.E.P. Santos. 2011. Concentration of progesterone during the development of the ovulatory follicle: II. Ovarian and uterine responses. J. Dairy Sci. 94:3352–3365. doi:10.3168/jds.2010-3734.
Cerri, R.L.A., H.M. Rutigliano, R.C. Chebel, and J.E.P. Santos. 2009. Period of dominance of the ovulatory follicle influences embryo quality in lactating dairy cows. Reproduction. 137:813–823. doi:10.1530/REP-08-0242.
Cerri, R.L.A., J.E.P. Santos, S.O. Juchem, K.N. Galvão, and R.C. Chebel. 2004. Timed artificial insemination with estradiol cypionate or insemination at estrus in high-producing dairy cows. J. Dairy Sci. 87:3704–3715. doi:10.3168/jds.S0022-0302(04)73509-2.
Chebel, R.C., J.E.P. Santos, R.L.A. Cerri, H.M. Rutigliano, and R.G.S. Bruno. 2006. Reproduction in dairy cows following progesterone insert presynchronization and resynchronization protocols. J. Dairy Sci. 89:4205-4219.
Chenault, J.R., W.W. Thatcher, P.S. Kalra, R.M. Abrams, and C.J. Wilcox. 1975. Transitory changes in plasma progestins, estradiol, and luteinizing hormone approaching ovulation in the bovine. J. Dairy Sci. 58:709–717. doi:10.3168/jds.S0022-0302(75)84632-7.
Cook, D.L., T.A. Winters, L.A. Horstman, and R.D. Allrich. 1986. Induction of estrus in ovariectomized cows and heifers: effects of estradiol benzoate and gonadotropin releasing hormone. J. Anim. Sci. 63:546-550.
Davoodi S., R.F. Cooke, A.C. Fernandes, B.I. Cappellozza, J.L. Vasconcelos, R.L. Cerri. 2016. Expression of estrus modifies the gene expression profile in reproductive tissues on Day 19 of gestation in beef cows. Theriogenology. 85:645-655. doi:10.1016/j.theriogenology.2015.10.002.
De Mol, R.M., E.J.B. Bleumer, P.H. Hogewerf, and A.H. Ipema. 2009. Recording of dairy cow behaviour with wireless accelerometers. In Precision Lovestock Farming ’09. C. Lokhorst and P.W.G. Groot Koerkamp, editors. Wageningen Academic Publishers, Wageningen, The Netherlands. 349–356.
Denis-Robichaud, J, R.L.A. Cerri, A. Jones-Bitton, and S.J. LeBlanc. 2015. Associations between management practices and reproductive performance in Canadian dairy herds. J. Dairy Sci. 98 (E-Suppl.1):874.
Firk, R., E. Stamer, W. Junge, and J. Krieter. 2002. Automation of oestrus detection in dairy cows: A review. Livest. Prod. Sci. 75:219–232. doi:10.1016/S0301-6226(01)00323-2.
Forde, N., M.E. Beltman, P. Lonergan, M. Diskin, J.F. Roche, and M.A. Crowe. 2011. Oestrous cycles in Bos taurus cattle. Anim. Reprod. Sci. 124:163–169. doi:10.1016/j.anireprosci.2010.08.025.
Fricke, P.M., J.O. Giordano, A. Valenza, G. Lopes, M.C. Amundson, and P.D. Carvalho. 2014. Reproductive performance of lactating dairy cows managed for first service using timed artificial insemination with or without detection of estrus using an activity-monitoring system. J. Dairy Sci. 97:2771–2781. doi:10.3168/jds.2013-7366.
Glencross, R.G., and G.S. Pope. 1981. Concentrations of oestradiol-17β and progesterone in the plasma of dairy heifers before and after cloprostenol-induced and natural luteolysis and during early pregnancy. Anim. Reprod. Sci. 4:93-106.
Helmer, S.D., and J.H. Britt. 1985. Mounting behavior as affected by stage of estrous cycle in Holstein heifers. J. Dairy Sci. 68:1290–1296. doi:10.3168/jds.S0022-0302(85)80959-0.
Holman, A., J. Thompson, J.E. Routly, J. Cameron, D.N. Jones, D. Grove-White, R.F. Smith, and H. Dobson. 2011. Comparison of oestrus detection methods in dairy cattle. Vet. Rec. 169:47–53. doi:10.1136/vr.d2344.
Hurnik, J.F., G.J. King, and H.A. Robertson. 1975. Estrous and related behaviour in postpartum Holstein cows. Appl. Anim. Ethol. 2:55–68.
Ing N.H., T.L. Ott. 1999. Estradiol up-regulates estrogen receptor-alpha messenger ribonucleic acid in sheep endometrium by increasing its stability. Biol. Reprod. 60:134-139.
Jinks E.M., M.F. Smith, J.A. Atkins, K.G. Pohler, G.A. Perry, M.D. MacNeil, A.J. Roberts, R.C. Waterman, L.J. Alexander, T.W. Geary. 2013 Preovulatory estradiol and the establishment and maintenance of pregnancy in suckled beef cows. J. Anim. Sci. 91:1176-1185. doi: 10.2527/jas.2012-5611.
Jónsson, R., M. Blanke, N.K. Poulsen, F. Caponetti, and S. Højsgaard. 2011. Oestrus detection in dairy cows from activity and lying data using on-line individual models. Comput. Electron. Agric. 76:6–15. doi:10.1016/j.compag.2010.12.014.
Kerbrat, S., and C. Disenhaus. 2004. A proposition for an updated behavioural characterisation of the oestrus period in dairy cows. Appl. Anim. Behav. Sci. 87:223–238. doi:10.1016/j.applanim.2003.12.001.
Kieborz-Loos K.R., H.A. Garverick, D.H. Keisler, S.A. Hamilton, B.E. Salfen, R.S. Youngquist, M.F. Smith. 2003. Oxytocin-induced secretion of prostaglandin F2alpha in postpartum beef cows: effects of progesterone and estradiol-17beta treatment. J. Anim. Sci. 81:1830-1836.
King R.S., G.J. Killian. 1994. Purification of bovine estrus-associated protein and localization of binding on sperm. Biol. Reprod. 51:34-42.
Lonergan P. 2011. Influence of progesterone on oocyte quality and embryo development in cows. Theriogenology. 76(9):1594-1601.
Lopez, H., L.D. Satter, and M.C. Wiltbank. 2004. Relationship between level of milk production and estrous behavior of lactating dairy cows. Anim. Reprod. Sci. 81:209–223.
López-Gatius, F., I. García-Ispierto, P. Santolaria, J. Yániz, C. Nogareda, and M. López-Béjar. 2006. Screening for high fertility in high-producing dairy cows. Theriogenology. 65:1678–1689. doi:10.1016/j.theriogenology.2005.09.027.
López-Gatius, F., P. Santolaria, I. Mundet, and J.L. Yániz. 2005. Walking activity at estrus and subsequent fertility in dairy cows. Theriogenology. 63:1419–1429. doi:10.1016/j.theriogenology.2004.07.007.
Løvendahl, P., and M.G.G. Chagunda. 2010. On the use of physical activity monitoring for estrus detection in dairy cows. J. Dairy Sci. 93:249–259. doi:10.3168/jds.2008-1721.
Lyimo, Z.C., M. Nielen, W. Ouweltjes, T.A.M. Kruip, and F.J.C.M. Van Eerdenburg. 2000. Relationship among estradiol, cortisol and intensity of estrus behavior in dairy cattle. Theriogenology. 53:1783–1795.
Madureira, A.M.L., T.A. Burnett, B.F. Silper, N. Dinn, and R.L.A. Cerri. 2013. Factors affecting expression of estrus of lactating dairy cows using activity monitors. J. Dairy Sci. 96(Suppl.1):600–601.
Madureira, A.M.L., B.F. Silper, T.A. Burnett, L.B. Polsky, L.H. Cruppe, J.L.M. Vasconcelos, R.L.A. Cerri. 2015a. Risk factors affecting expression of estrus measured by activity monitors and pregnancy per artificial insemination of lactating dairy cows. J. Dairy Sci. 98:7003-7014.
Madureira, A.M.L., B.F. Silper, T.A. Burnett, L.B. Polsky, E.L. Drago Filho, S. Soriano, A.F. Sica, J.L.M. Vasconcelos, R.L.A. Cerri. 2015b. Effects of expression of estrus measured by activity monitors on ovarian dynamics and conception risk in Holstein cows. J. Dairy Sci. 98(Suppl.1):875.
Mann, G.E., and G.E. Lamming. 2000. The role of sub-optimal preovulatory oestradiol secretion in the aetiology of premature luteolysis during the short oestrous cycle in the cow. Anim. Reprod. Sci. 64:171–180. doi:10.1016/S0378-4320(00)00205-0.
Mann G.E., and G.E. Lamming. GE. 2001. Relationship between maternal endocrine environment, early embryo development and inhibition of the luteolytic mechanism in cows. Reproduction. 121(1):175-80.
Morris, M.J., S.L. Walker, D.N. Jones, J.E. Routly, R.F. Smith, and H. Dobson. 2009. Influence of somatic cell count, body condition and lameness on follicular growth and ovulation in dairy cows. Theriogenology. 71:801-806.
Moore, N.W., and B.G. Miller. 1976. Progesterone and oestrogen requirements for the survival of embryos in the ovariectomized ewe. J. Reprod. Fertil. 46:536-7.
Murray M.K. 1993 An estrogen-dependent glycoprotein is synthesized and released from the oviduct in a temporal- and region-specific manner during early pregnancy in the ewe. Biol Reprod. 48:446-453.
Murray M.K. 1992 Biosynthesis and immunocytochemical localization of an estrogen-dependent glycoprotein and associated morphological alterations in the sheep ampulla oviduct. Biol Reprod. 47:889-902.
Mussard, M.L., C.R. Burke, and M.L. Day. 2003. Ovarian follicle maturity at induced ovulation influences fertility in cattle. Pages 179–185 in Proc. Annu. Conf. Soc. Theriogenology, Columbus, OH.
Neves, R.C., and S.J. LeBlanc. 2015. Reproductive management practices and performance of Canadian dairy herds using automated activity-monitoring systems. J. Dairy Sci. 98:2801–2811. doi:10.3168/jds.2014-8221.
Neves, R.C., K.E. Leslie, J.S. Walton, and S.J. Leblanc. 2012. Reproductive performance with an automated activity monitoring system versus a synchronized breeding program. J. Dairy Sci. 95:5683–5693. doi:10.3168/jds.2011-5264.
Pahl, C., E. Hartung, and A. Haeussermann. 2015. Feeding characteristics and rumination time of dairy cows around estrus. J. Dairy Sci. 98:148–154. doi:10.3168/jds.2014-8025.
Pennington, J.A., J.L. Albright, and C.J. Callahan. 1986. Relationships of sexual activities in estrous cows to different frequencies of observation and pedometer measurements. J. Dairy Sci. 69:2925–2934. doi:10.3168/jds.S0022-0302(86)80748-2.
Pennington, J.A., J.L. Albright, M.A. Diekman, and C.J. Callahan. 1985. Sexual activity of Holstein cows: seasonal effects. J. Dairy Sci. 68:3023–3030. doi:10.3168/jds.S0022-0302(85)81197-8.
Peralta, O.A., R.E. Pearson, and R.L. Nebel. 2005. Comparison of three estrus detection systems during summer in a large commercial dairy herd. Anim. Reprod. Sci. 87:59–72. doi:10.1016/j.anireprosci.2004.10.003.
Pereira, M.H.C., M.C. Wiltbank, J.L.M. Vasconcelos. 2015. Expression of estrus improves fertility and decreases pregnancy losses in lactating dairy cows that receive artificial insemination or embryo transfer. J. Dairy Sci. pii: S0022-0302(15)00944-3. doi: 10.3168/jds.2015-9903.
Pereira, M.H.C., A.D. Rodrigues, R.J. De Carvalho, M.C. Wiltbank, J.L.M. Vasconcelos. 2014. Increasing length of an estradiol and progesterone timed artificial insemination protocol decreases pregnancy losses in lactating dairy cows. J. Dairy Sci. 97(3):1454-64. doi: 10.3168/jds.2013-7287.
Pereira, M.H.C., C.P. Sanches, T.G. Guida, A.D. Rodrigues, F.L. Aragon, M.B. Veras, P.T. Borges, M.C. Wiltbank, J.L.M. Vasconcelos. 2013. Timing of prostaglandin F2α treatment in an estrogen-based protocol for timed artificial insemination or timed embryo transfer in lactating dairy cows. J. Dairy Sci. 96(5):2837-46. doi: 10.3168/jds.2012-5840.
Pursley, J.R., M.O. Mee, and M.C. Wiltbank. 1995. Synchronization of ovulation in dairy cows using PGF2alpha and GnRH. Theriogenology. 44:915–923. doi:10.1016/0093-691X(95)00279-H.
Pushpakumara P.G., R.S. Robinson, K.J. Demmers, G.E. Mann, K.D. Sinclair, R. Webb, D.C. Wathes. 2002. Expression of the insulin-like growth factor (IGF) system in the bovine oviduct at oestrus and during early pregnancy. Reproduction. 123:859-868.
Rhodes, F.M., S. McDougall, C.R. Burke, G.A. Verkerk, and K.L. Macmillan. 2002. Invited Review: Treatment of Cows with an Extended Postpartum Anestrous Interval. J. Dairy Sci. 86:1876–1894. doi:10.3168/jds.S0022-0302(03)73775-8.
Rivera, F., C. Narciso, R. Oliveira, R.L.A. Cerri, A. Correa-Calderón, R.C. Chebel, and J.E.P. Santos. 2010. Effect of bovine somatotropin (500 mg) administered at ten-day intervals on ovulatory responses, expression of estrus, and fertility in dairy cows. J. Dairy Sci. 93:1500–1510. doi:10.3168/jds.2009-2489.
Robinson, R.S., G.E. Mann, T.S. Gadd, G.E. Lamming, D.C. Wathes. 2000. The expression of the IGF system in the bovine uterus throughout the oestrous cycle and early pregnancy. J. Endocrinol. 2000 165(2):231-43.
Robinson, R. S., G. E. Mann, G. E. Lamming, and D. C. Wathes. 2001. Expression of oxytocin, oestrogen and progesterone receptors in uterine biopsy samples throughout the oestrous cycle and early pregnancy in cows. Reproduction 122:965–79.
Roelofs, J., F. López-Gatius, R.H.F. Hunter, F.J.C.M. van Eerdenburg, and C. Hanzen. 2010. When is a cow in estrus? Clinical and practical aspects. Theriogenology. 74:327–344. doi:10.1016/j.theriogenology.2010.02.016.
Roelofs, J.B., F.J.C.M. van Eerdenburg, N.M. Soede, and B. Kemp. 2005. Various behavioral signs of estrous and their relationship with time of ovulation in dairy cattle. Theriogenology. 63:1366–1377. doi:10.1016/j.theriogenology.2004.07.009.
Rutten, C.J., A.G.J. Velthuis, W. Steeneveld, and H. Hogeveen. 2013. Invited review: sensors to support health management on dairy farms. J. Dairy Sci. 96:1928–1952. doi:10.3168/jds.2012-6107.
Sangsritavong, S., D.K. Combs, R. Sartori, L.E. Armentano, and M.C. Wiltbank. 2002. High feed intake increases liver blood flow and metabolism of progesterone and estradiol-17beta in dairy cattle. J. Dairy Sci. 85:2831–2842. doi:10.3168/jds.S0022-0302(02)74370-1.
Santos, J.E.P., H.M. Rutigliano, and M.F. Sá Filho. 2009. Risk factors for resumption of postpartum estrous cycles and embryonic survival in lactating dairy cows. Anim. Reprod. Sci. 110:207–221. doi:10.1016/j.anireprosci.2008.01.014.
Sartori, R., J.M. Haughian, R.D. Shaver, G.J.M. Rosa, and M.C. Wiltbank. 2004. Comparison of Ovarian Function and Circulating Steroids in Estrous Cycles of Holstein Heifers and Lactating Cows. J. Dairy Sci. 87:905–920. doi:10.3168/jds.S0022-0302(04)73235-X.
Sartori, R., G.J.M. Rosa, and M.C. Wiltbank. 2002. Ovarian structures and circulating steroids in heifers and lactating cows in summer and lactating and dry cows in winter. J. Dairy Sci. 85:2813.
Saumande, J., and P. Humblot. 2005. The variability in the interval between estrus and ovulation in cattle and its determinants. Anim. Reprod. Sci. 85:171–182. doi:10.1016/j.anireprosci.2003.09.009.
Silper, B.F., I. Robles, A.M.L. Madureira, T.A. Burnett, M.M Reis, A.M. de Passillé, J. Rushen, and R.L.A. Cerri. 2015a. Automated and visual measurements of estrous behavior and their sources of variation in Holstein heifers I: Walking activity and behavior frequency. Theriogenology. 84:312-320.
Silper, B.F., L. Polsky, J. Luu, T.A. Burnett, M.M Reis, A.M. de Passillé, J. Rushen, and R.L.A. Cerri. 2015b. Automated and visual measurements of estrous behavior and their sources of variation in Holstein heifers II: Standing and lying patterns. Theriogenology. 84:333-341.
Silper, B.F., A.M.L. Madureira, M. Kaur, T.A. Burnett, and R.L.A. Cerri. 2015c. Short communication: Comparison of estrus characteristics in Holstein heifers by 2 activity monitoring systems. J. Dairy Sci. 98:3158-3165. doi:10.3168/jds.2014-9185.
Silper, B.F., A.M.L. Madureira, L.B. Polsky, E.L. Drago Filho, J.L.M. Vasconcelos, and R.L.A. Cerri. 2015d. Estrus lying behavior of Holstein cows: Risk factors for estrus expression, ovulation risk and pregnancy per AI. J. Dairy Sci. 98(Suppl.1):96.
Souza A.H., H. Ayres, R.M. Ferreira, M.C. Wiltbank. 2008. A new presynchronization system (Double-Ovsynch) increases fertility at first postpartum timed AI in lactating dairy cows, Theriogenology, 70:208-215. https://dx.doi.org/10.1016/j.theriogenology.2008.03.014.
Spencer T.E., F.W. Bazer. 1995. Temporal and spatial alterations in uterine estrogen receptor and progesterone receptor gene expression during the estrous cycle and early pregnancy in the ewe. Biol Reprod. 53:1527-1543.
Stevenson, J.S., S.L. Hill, R.L. Nebel, and J.M. Dejarnette. 2014. Ovulation timing and conception risk after automated activity monitoring in lactating dairy cows. J. Dairy Sci. 97:4296–4308. doi:10.3168/jds.2013-7873.
Sveberg, G., A.O. Refsdal, H.W. Erhard, E. Kommisrud, M. Aldrin, I.F. Tvete, F. Buckley, A. Waldmann, and E. Ropstad. 2011. Behavior of lactating Holstein-Friesian cows during spontaneous cycles of estrus. J. Dairy Sci. 94:1289–1301. doi:10.3168/jds.2010-3570.
Vailes, L.D., S.P. Washburn, and J.H. Britt. 1992. Effects of various steroid milieus or physiological states on sexual behavior of Holstein cows. J. Anim. Sci. 70:2094–2103.
Valenza, A., J.O. Giordano, G. Lopes, L. Vincenti, M.C. Amundson, and P.M. Fricke. 2012. Assessment of an accelerometer system for detection of estrus and treatment with gonadotropin-releasing hormone at the time of insemination in lactating dairy cows. J. Dairy Sci. 95:7115–7127. doi:10.3168/jds.2012-5639.
Van Eerdenburg, F.J., I.A. Daemen, E.M. van der Beek, and F.W. van Leeuwen. 2000. Changes in estrogen-alpha receptor immunoreactivity during the estrous cycle in lactating dairy cattle. Brain Res. 880:219–223.
Van Eerdenburg, F.J.C.M., H.S.H. Loeffler, and J.H. van Vliet. 1996. Detection of oestrus in dairy cows: A new approach to an old problem. Vet. Q. 18:52–54. doi:10.1080/01652176.1996.9694615.
Van Vliet, J.H., and F.J.C.M. Van Eerdenburg. 1996. Sexual activities and oestrus detection in lactating Holstein cows. Appl. Anim. Behav. Sci. 50:57–69. doi:10.1016/0168-1591(96)01068-4.
Vasconcelos, J.L.M., S. Sangsritavong, S.J. Tsai, and M.C. Wiltbank. 2003. Acute reduction in serum progesterone concentrations after feed intake in dairy cows. Theriogenology. 60:795–807. doi:10.1016/S0093-691X(03)00102-X.
Veerkamp, R.F., J.K. Oldenbroek, H.J. van der Gaast, and J.H.J van der Werf. 2000. Genetic correlation between days until start of luteal activity and milk yield, energy balance, and live weights. J. Dairy Sci. 83:577-583.
Walker, W.L., R.L. Nebel, and M.L. McGilliard. 1996. Time of ovulation relative to mounting activity in dairy cattle. J. Dairy. Sci. 79:1555-1561.
Walker, S.L., R.F. Smith, J.E. Routly, D.N. Jones, M.J. Morris, and H. Dobson. 2008. Lameness, activity time-budgets, and estrus expression in dairy cattle. J. Dairy Sci. 91:4552–4559. doi:10.3168/jds.2008-1048.
Wiltbank, M.C., G.M. Baez, F. Cochrane, R. V Barletta, C.R. Trayford, and R.T. Joseph. 2015. Effect of a second treatment with prostaglandin F 2α during the Ovsynch protocol on luteolysis and pregnancy in dairy cows. J. Dairy Sci. 1–11. doi:10.3168/jds.2015-9353.
Woelders, H., T. van der Lende, A. Kommadath, M.F.W. Te Pas, M.A. Smits, and L.M.T.E. Kaal. 2014. Central genomic regulation of the expression of oestrous behaviour in dairy cows: a review. Animal. 8:754–764. doi:10.1017/S1751731114000342.

 FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS
FAÇA SEU LOGIN E ACESSE CONTEÚDOS EXCLUSIVOS














